Перейти к:
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ХЛОРИДА ЛИТИЯ В ДОЗЕ 63 И 21 МИЛЛИГРАММ НА КИЛОГРАММ ЧЕРЕЗ 60 И 180 МИНУТ ПРИ МОДЕЛИРОВАНИИ ЧЕРЕПНО‑МОЗГОВОЙ ТРАВМЫ
https://doi.org/10.35266/2949-3447-2025-3-12
Аннотация
Травматическое повреждение головного мозга является главной причиной смертельных исходов и наступления инвалидности, влекущей за собой значительные физические, социальные и экономические последствия. Изучение нейропротекторных свойств фармакологических препаратов является важной научной задачей. Цель исследования: сравнение эффективности действия хлорида лития в дозе 63 и 21 мг/кг через 60 и 180 минут после экспериментального моделирования открытой черепно-мозговой травмы у крыс. В исследование включены крысы-самцы линии Вистар (n = 60): контрольная группа, ложнооперированные животные и четыре группы в зависимости от вводимой дозы хлорида лития и интервалов времени. Для изучения объема повреждения головного мозга крыс на 14‑й день после черепно-мозговой травмы выполнили магнитно-резонансную томографию. При сравнении влияния хлорида лития в исследуемых группах на объем повреждения головного мозга было показано, что наиболее эффективной является доза 63 мг/кг, введенная через 60 мин после моделирования черепно-мозговой травмы.
Для цитирования:
Шарикадзе Д.Т., Габитов М.В., Гребенчиков О.А., Долгих В.Т., Кузовлев А.Н. СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ХЛОРИДА ЛИТИЯ В ДОЗЕ 63 И 21 МИЛЛИГРАММ НА КИЛОГРАММ ЧЕРЕЗ 60 И 180 МИНУТ ПРИ МОДЕЛИРОВАНИИ ЧЕРЕПНО‑МОЗГОВОЙ ТРАВМЫ. Вестник СурГУ. Медицина. 2025;18(3):92-99. https://doi.org/10.35266/2949-3447-2025-3-12
For citation:
Sharikadze D.T., Gabitov M.V., Grebenchikov O.A., Dolgikh V.T., Kuzovlev A.N. COMPARISON OF LITHIUM CHLORIDE EFFECT IN DOSE OF 63 MG/KG AND 21 MG/KG AFTER 60 AND 180 MINUTES IN TRAUMATIC BRAIN INJURY MODELING. Vestnik SurGU. Meditsina. 2025;18(3):92-99. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-12
ВВЕДЕНИЕ
Травматическое повреждение головного мозга является главной причиной смертельных исходов и наступления инвалидности, влекущей за собой значительные физические, социальные и экономические последствия. К известным причинам черепно-мозговой травмы (ЧМТ) относят травмоопасные виды спорта, бытовой и производственный травматизм, падения с высоты, преступность и дорожно-транспортные происшествия.
По данным Центра по контролю и профилактике заболеваний в США (the United States Center for Disease Control, https://www.cdc.gov) от 3 до 5 млн человек являются инвалидами вследствие ЧМТ, которая привела к расстройству опорно-двигательного аппарата и неврологическим последствиям (деменция, энцефалопатия, эпилепсия) [1]. Каждый год в России регистрируется более 500 тыс. различных травм головного мозга, при этом около 50 тыс. людей умирают. Посттравматические неврологические нарушения, непосредственно вызвавшие инвалидность, имеют более 2 млн человек в нашей стране [2].
Более 200 лет ведущие ученые работают над концепцией патогенеза ЧМТ: молекулярная теория сотрясения и градиента давления предложена J. Petit (1774) и T. Kocher (1880), теория инерционного внутричерепного смещения и кавитационного повреждения мозга описана W. Russel (1932) и A. Gross (1958), теория деформации и ликворного удара – А. Hirsch и Е. Flamm (1966), а также Н. Duret (1978). Приведенный выше перечень подтверждает трудность в выборе вектора при описании вариабельности патофизиологических процессов травматического повреждения головного мозга.
Принято считать, что к первичным повреждениям при ЧМТ относят сотрясение и контузию, переломы черепа, рваные раны, размозжение мозга, диффузное аксональное повреждение, разрыв ствола мозга и проникающие ранения. Время соударения занимает около 100 мс, при этом чем оно меньше, тем больше травматической энергии передается головному мозгу и тем более фатальный объем травмы. Вторичные повреждения мозга имеют отсроченный характер и включают в себя дисрегуляцию мозгового кровообращения, эксайтотоксичность глутамата, оксидантный стресс, анаэробный метаболизм и митохондриальную дисфункцию, отек мозга, повреждение ДНК, некроз и апоптоз.
Отсутствие унифицированных стандартов терапии ЧМТ подчеркивает необходимость поиска надежных биомаркеров, позволяющих повысить точность диагностики и прогнозирования исходов. Крупные международные программы CENTER-TBI и TRACK-TBI убедительно показали, что концентрации ряда белков – глиального фибриллярного кислого белка (GFAP), убиквитин-С-терминальной гидролазы-L1 (UCH-L1), кальций-связывающего белка S100B и нейрофиламентного легкого полипептида (NF-L) – отражают степень структурного повреждения и тесно связаны с клиническим течением заболевания [3][4]. Эти маркеры рассматриваются не только как диагностические индикаторы, но и как перспективные инструменты стратификации пациентов по риску неблагоприятного исхода. Их внедрение открывает возможности для персонализированного подхода к ведению больных с ЧМТ, включая выбор оптимальной тактики интенсивной терапии и прогнозирование долгосрочного восстановления.
Нейропротекция – способность нейронов к адаптации в экстремальных условиях для сохранения клеточной структуры и базовых функций мозга. Хлорид лития является перспективным препаратом, обладающим органопротекторными свойствами в экспериментальных условиях [5–7]. Известны подтвержденные данные о влиянии лития на ключевые звенья вторичных повреждений головного мозга, таких как нейротрофический фактор мозга, фермент гликоген-синтаза киназа-3, провоспалительные цитокины, мишень рапамицина млекопитающих и др. [8–11].
По данным работ О. А. Гребенчикова и Р. А. Черпакова установлено, что применение хлорида лития (21 мг/кг и 63 мг/кг) при моделировании фокальной ишемии у лабораторных животных уменьшает перифокальный отек и зону инсульта [12].
Существующие экспериментальные данные о действии солей лития при ЧМТ пока немногочисленны, однако они в целом подтверждают предположение о наличии выраженного нейропротекторного потенциала. При этом следует отметить, что большинство проведенных работ основывалось на доклинических протоколах с введением препарата до моделирования травмы, что искусственно усиливает протективный эффект и ограничивает экстраполяцию результатов на клиническую практику. В реальных условиях повреждение головного мозга возникает внезапно, поэтому наиболее значимой представляется оценка эффективности лития при его отсроченном применении. Такой подход ближе к клиническим сценариям и позволяет судить о возможности использования препарата как терапевтического средства, а не только как средства превентивной защиты [13].
Цель – сравнение эффективности действия хлорида лития в дозе 63 и 21 мг/кг через 60 и 180 минут после экспериментального моделирования открытой черепно-мозговой травмы у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены крысы линии Вистар весом 250–350 г (n = 60) и разделены на 6 групп.
- Ложнооперированные животные, которым проводили анестезию и подготовительные мероприятия с наложением фрезевого отверстия (название – ЛО, n= 10).
- Контрольная группа животных, которым после моделирования открытой черепно-мозговой травмы (ОЧМТ) вводился 0,9 % раствор хлорида натрия (название – Контроль, n= 10).
- Животные, которым через 60 мин после моделирования ОЧМТ внутривенно вводился раствор хлорид лития 4,2 % в дозе 63 мг/кг (название – ОЧМТ+Литий 60 мин/63 мг, n= 10).
- Животные, которым через 60 мин после моделирования ОЧМТ внутривенно вводился раствор хлорид лития 4,2 % в дозе 21 мг/кг (название – ОЧМТ+Литий 60 мин/21 мг, n= 10).
- Животные, которым через 180 мин после моделирования ОЧМТ внутривенно вводился раствор хлорид лития 4,2 % в дозе 63 мг/кг (название – ОЧМТ+Литий 180 мин/63 мг, n= 10).
- Животные, которым через 180 мин после моделирования ОЧМТ внутривенно вводился раствор хлорид лития 4,2 % в дозе 21 мг/кг (название – ОЧМТ+Литий 180 мин/21 мг, n= 10).
Экспериментальное моделирование ОЧМТ выполнялось по методу дозированного контузионного повреждения открытого мозга [1][2].
Этапы экспериментального исследования:
Подготовка операционного поля: кожа на голове крысы выбривалась и обрабатывалась антисептиком (хлоргексидин 0,05 %). Для подготовки к хирургическому доступу крысу размещали в стереотаксической раме, голову фиксировали и выполняли разрез кожи. Для воспроизведения модели ОЧМТ выполняли трепанацию в проекции сенсомоторной коры левого полушария. Хирургический доступ осуществляли с использованием микрофрезы диаметром 5 мм, формируя отверстие на границе теменной и лобной костей. Локализация операционного окна определялась по стандартным стереотаксическим координатам: 2,5 мм латерально от сагиттального шва и 1,5 мм каудально относительно брегмы. Для нанесения травмы применялся боек массой 50 г, который фиксировали в установке и располагали строго перпендикулярно к поверхности твердой мозговой оболочки на высоте 10 см, что обеспечивало контролируемое воздействие с воспроизводимым уровнем кинетической энергии.
По завершении травмирующего воздействия мягкие ткани ушивались послойно с использованием рассасывающегося шовного материала (Vicril 4–0), после чего операционное поле обрабатывалось 5 % раствором бриллиантового зеленого. В раннем посттравматическом периоде особое внимание уделялось поддержанию стабильной температуры тела животных (37 ± 0,5 °C), что достигалось применением электрической подогреваемой платформы.
Для оценки отдаленных последствий ЧМТ на 14-е сутки проводили магнитно-резонансную томографию (МРТ) головного мозга. Исследование выполняли на высокопольном томографе (BioSpec 70:30, Bruker, Германия) с напряженностью магнитного поля 7 Т и системой градиентов мощностью 105 мТл/м. В качестве анестетика использовали изофлуран (1,5–2 об. %), позволяющий поддерживать стабильный наркоз в течение всего исследования.
Протокол МРТ включал получение Т2-взвешенных изображений. Для передачи радиочастотных импульсов использовалась линейная катушка диаметром 72 мм, а регистрация сигнала осуществлялась с помощью специализированной поверхностной приемной катушки, предназначенной для работы с мозгом мелких животных. Применялась импульсная последовательность RARE (rapid imaging with refocused echoes), основанная на методике спин-эхо, с параметрами: TR – 6 000 мс, TE – 63,9 мс, толщина среза – 0,8 мм при межсрезовом интервале 0,8 мм; матрица реконструкции составляла 256 × 384, что обеспечивало пространственное разрешение 0,164 × 0,164 мм/пиксель. Средняя продолжительность сканирования одного животного составляла около 25 мин.
Весь эксперимент выполнен в соответствии с Европейской конвенцией ETS № 123 о защите позвоночных животных, используемых для экспериментов или в научных целях (Страсбург) от 18.03.1986 с приложением от 15.06.2006; Международным соглашением о гуманном обращении с животными от 24.11.1986; Guide for the care and use of laboratory animals, 8th edition (Руководство по уходу и использованию лабораторных животных, 2010 г.); Directive 2010/63/EUof the European parliament and of the council on the protection of animals used for scientific purposes от 22.09.2010; «Правилами надлежащей лабораторной практики», утвержденными приказом Министерства здравоохранения России от 01.04.2016 № 199н.
Морфометрический анализ полученных изображений проводили с использованием пакета ImageJ (NIH, Bethesda, США). Определяли площадь повреждения на срезе с максимальным объемом очага, дополнительно анализируя четыре соседних уровня (два выше и два ниже центрального). Итоговый объем зоны повреждения вычисляли по планиметрической формуле V = ΣSn × d, где d – толщина среза (0,8 мм), ΣSn – суммарная площадь очага на пяти выбранных уровнях. Такой подход позволял повысить точность оценки объема повреждения и минимизировать влияние артефактов, связанных с неоднородностью сигнала.
При статистическом анализе полученных данных мы применяли следующие критерии и тесты: точный тест Фишера, критерий Шапиро – Уилка, U-критерий Манна – Уитни, критерий χ2 Пирсона, тест Крускала – Уоллиса с множественными сравнениями Данна. Результаты, приведенные в исследовании, представлены в виде медианы, первого и третьего квартилей [Q1, Q3]. Статистические вычисления проводились на платформах IBM SPSS Statistics и GraphPad Prizm.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Хлорид лития – препарат, обладающий протективными свойствами. По данным исследований, он является ингибитором ГСК-3β, вызывая антиапоптотические эффекты. Литий предотвращает гибель клеток от окислительного стресса, доказаны его кардиопротекторные свойства на экспериментальной модели инфаркта миокарда in vivo и нейропротекторные эффекты на модели ишемического инсульта у крыс. Полученные данные позволяют утверждать, что литий способен модулировать ключевые звенья патогенеза повреждения центральной нервной системы, включая процессы эксайтотоксичности, окислительного стресса и апоптотической гибели клеток, что в совокупности приводит к снижению выраженности структурного и функционального ущерба.
Для верификации нейропротекторного действия хлорида лития в эксперименте была использована воспроизводимая модель ОЧМТ у крыс. Выбор данной модели обусловлен ее близостью к клиническим условиям, а также наличием гипотезы о том, что соли лития способны проявлять защитные свойства даже в условиях тяжелого повреждения нервной ткани.
Оценку степени церебрального повреждения проводили на 14-е сутки после нанесения травмы, что соответствует периоду стабилизации посттравматических изменений и позволяет объективно оценить долгосрочный эффект терапии. Для этого использовали морфометрический анализ МРТ-изображений, включавший измерение объема повреждения в трех группах: ложнооперированных животных (n = 10), контрольных после ЧМТ (n = 10) и опытной группы с введением хлорида лития в дозе 63 мг/кг через 60 мин после травмы (n = 10).
Сравнительный анализ томографических данных показал, что в группе, получавшей литий, объем повреждения головного мозга был достоверно ниже, чем в контрольной. Так, медианное значение данного показателя составило 20,5 мм 3 против 35,0 мм 3 в контроле, что подтверждает выраженный нейропротективный потенциал препарата при раннем отсроченном введении (рис. 1, табл. 1).
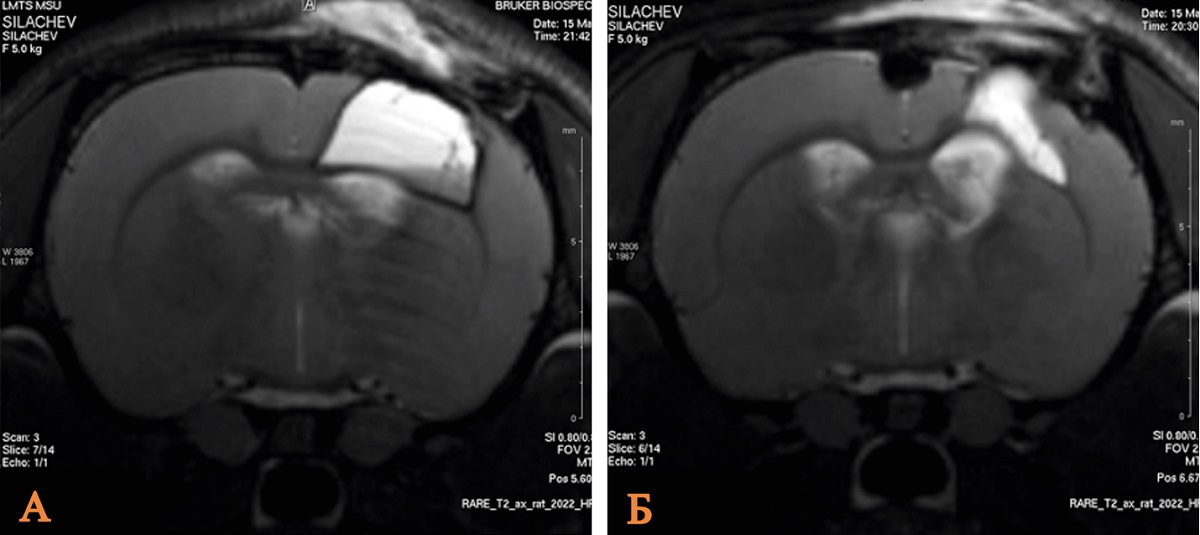
Рис. 1. МРТ зоны ушиба головного мозга крысы после введения хлорида лития в дозе 63 мг/кг через 60 мин в сравнении с контрольной группой
Примечание: А – группа Контроль; Б – группа ОЧМТ+Литий 60 мин/63 мг. Изображение авторов, получено в ходе оригинального исследования.
Таблица 1
Объем повреждения головного мозга крыс в группе ОЧМТ+Литий 60 мин/63 мг и группе сравнения по данным МРТ-изображений на 14-е сутки наблюдения
Группа | Объем повреждения головного мозга, мм 3 | p, значимость относительно ложнооперированных животных | p, значимость относительно контрольных животных |
Ложнооперированные животные (n = 10) | 12,0 [8,0–14,5] | – | – |
Контроль (n = 10) | 35,0 [30–36] | 0,0001 | – |
ОЧМТ+Литий 60 мин/63 мг (n = 10) | 20,5 [17–22,5] | – | 0,001 |
Примечание: составлено авторами.
При изучении объема повреждения головного мозга крыс после ОЧМТ при введении хлорида лития в дозе 21 мг/кг через 60 мин проведено исследование объема повреждения головного мозга по данным морфометрического анализа МР-изображений в группах ложнооперированных животных (n = 10), группе Контроль (n = 10) и ОЧМТ+Литий 60 мин/21 мг (n = 10).
При анализе данных МРТ выявлено, что средний объем повреждения головного мозга крыс был статистически значимо меньше в группе ОЧМТ+Литий 60 мин/21 мг, чем в группе Контроль. По данным МРТ, исследуемый показатель в группах сравнения составил 25,5 mm3 и 35,0 mm3 соответственно (рис. 2, табл. 2).
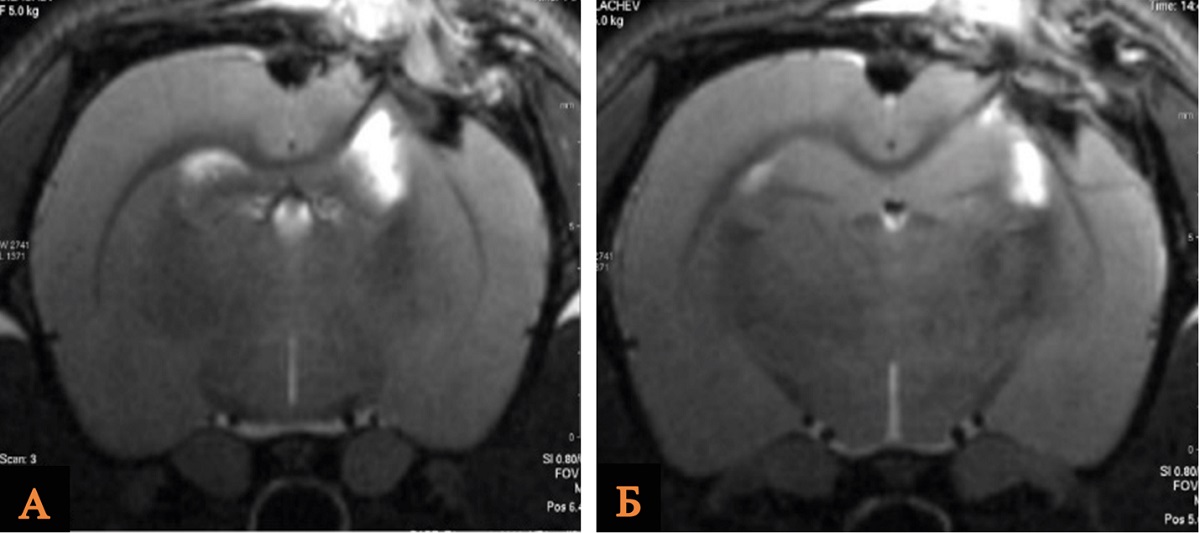
Рис. 2. МРТ зоны ушиба головного мозга крысы после введения хлорида лития в дозе 21 мг/кг через 60 мин в сравнении с контрольной группой
Примечание: А – группа Контроль; Б – группа ОЧМТ+Литий 60 мин/21 мг. Изображение авторов, получено в ходе оригинального исследования.
Таблица 2
Объем повреждения головного мозга крыс в группе ОЧМТ+Литий 60 мин/21 мг и группах сравнения по данным МРТ-изображений на 14-е сутки наблюдения
Группа | Объем повреждения головного мозга мм 3 | p, значимость относительно ложнооперированных животных | p, значимость относительно контрольных животных |
Ложнооперированные животные | 12,0 [8,0–14,5] | – | – |
Контроль (n = 10) | 35,0 [30–36] | 0,0001 | – |
ОЧМТ+Литий 60 мин/21 мг (n = 10) | 25,5 [21–29,5] | 0,01 | 0,03 |
Примечание: составлено авторами.
При изучении объема повреждения головного мозга крыс после ОЧМТ при введении хлорида лития в дозе 63 мг/кг через 180 мин проведено исследование объема повреждения головного мозга крыс по данным морфометрического анализа МР-изображений в группах ложнооперированных животных (n = 10), группе Контроль (n = 10) и ОЧМТ+Литий 180 мин/63 мг (n = 10).
Анализируя полученные данные, мы выявили, что средний объем повреждения головного мозга крыс был статистически значимо меньше в группе ОЧМТ+Литий 180 мин/63 мг, чем в группе Контроль. По данным МРТ, исследуемый показатель в группах сравнения составил 28,0 и 35,0 mm3 соответственно (рис. 3, табл. 3).
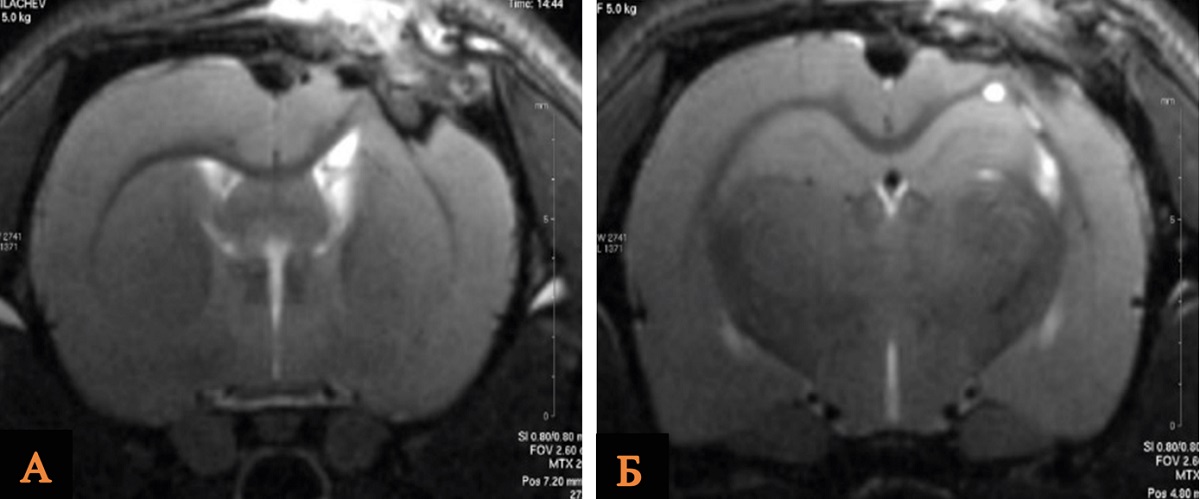
Рис. 3. МРТ зоны ушиба головного мозга крысы после введения хлорида лития в дозе 63 мг/кг через 180 мин в сравнении с контрольной группой
Примечание: А – группа Контроль; Б – группа ОЧМТ+Литий 180 мин/63 мг. Изображение авторов, получено в ходе оригинального исследования.
Таблица 3
Объем повреждения головного мозга крыс в группе ОЧМТ+Литий 180 мин/63 мг и группах сравнения по данным МРТ-изображений на 14-е сутки наблюдения
Группа | Объем повреждения головного мозга мм 3 | p, значимость относительно ложнооперированных животных | p, значимость относительно контрольных животных |
Ложнооперированные животные (n = 10) | 12,0 [8,0–14,5] | – | – |
Контроль (n = 10) | 35 [30–36] | 0,0001 | – |
ОЧМТ+Литий 180 мин/63 мг (n = 10) | 28 [23–30,5] | 0,001 | 0,03 |
Примечание: составлено авторами.
Исследование объема повреждения головного мозга проводили по данным морфометрического анализа МР-томографических изображений в группах ложнооперированных животных (n = 10), контрольных (n =10) и группе ОЧМТ+Литий 180 мин/21 мг (n = 10).
Анализ полученных данных выявил статистически незначимые различия в исследуемых группах: средний объем церебральных повреждений в группе ОЧМТ+Литий 180 мин/21 мг был меньше, чем в контрольной группе и составил 31,5 и 35,0 mm3 соответственно (рис. 4, табл. 4).
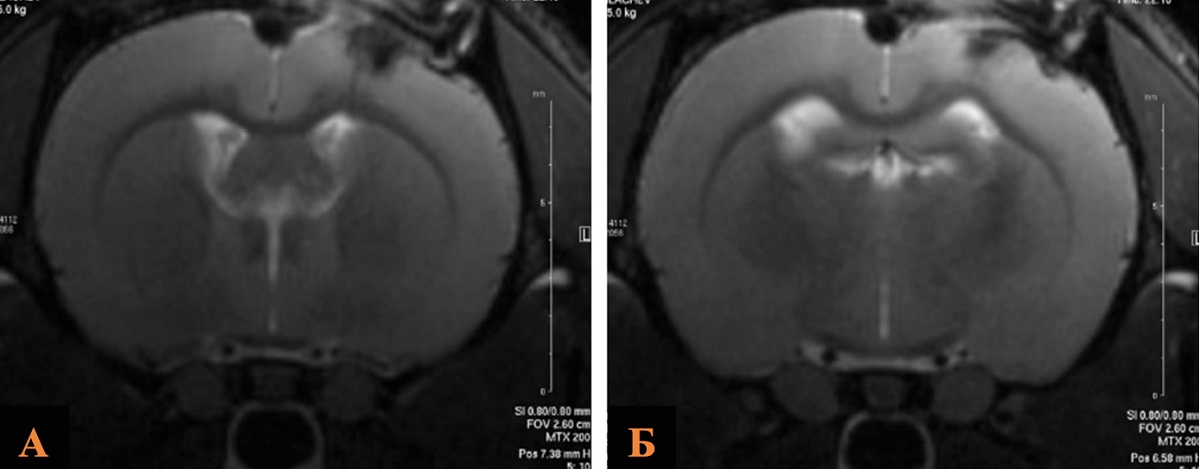
Рис. 4. МРТ зоны ушиба головного мозга крысы после введения хлорида лития в дозе 21 мг/кг через 180 мин в сравнении с контрольной группой
Примечание: А – группа Контроль; Б – группа ОЧМТ+Литий 180 мин/21 мг. Изображение авторов, получено в ходе оригинального исследования.
Таблица 4
Объем повреждения головного мозга крыс в группе ОЧМТ+Литий 180 мин/21 мг и группах сравнения по данным МРТ-изображений на 14-е сутки наблюдения
Группа | Объем повреждения головного мозга мм 3 | p, значимость относительно ложнооперированных животных | p, значимость относительно контрольных животных |
Ложнооперированные животные (n = 10) | 12,0 [8,0–14,5] | – | – |
Контроль (n = 10) | 35 [30–36] | 0,0001 | – |
ОЧМТ+Литий 180 мин/21 мг (n = 10) | 31,5 [25–33,5] | 0,001 | 0,09 |
Примечание: составлено авторами.
На основании полученных данных можно утверждать, что применение методики терапии хлоридом лития (4,2 % раствор в/в в дозе 21 мг/кг) через 180 мин после моделирования ОЧМТ у крыс линии Вистар снижает объем повреждения головного мозга крыс на 10 %.
В исследовании Фэншань Юй и соавт. на модели ЧМТ у мышей применяли хлорид лития через 15 мин после травмы. Были получены сопоставимые данные. Однако в отличие от нашего исследования, где хлорид лития применялся в дозе 0,5 и 1,5 ммоль/л (63 и 21 мг/кг), доза препарата в данном исследовании была в 2 раза выше. Так, литий в дозах 2,0 и 3,0 ммоль/кг значимо уменьшал объем повреждения головного мозга через 3 дня после моделирования ЧМТ [14].
В исследовании Цзу Фучжу и соавт. получены сопоставимые данные – введение лития уменьшало отек и нейродегенерацию гиппокампа, улучшало память и пространственное обучение после ЧМТ. Однако в отличие от нашего исследования, литий вводился ежедневно в течение 2 недель перед моделированием ЧМТ [15].
ЗАКЛЮЧЕНИЕ
Итоги проведенной экспериментальной работы подтверждают, что хлорид лития способен реализовывать нейропротективный потенциал в условиях ОЧМТ. На моделях крыс было показано, что введение препарата в дозах 0,5 и 1,5 ммоль/кг способствует достоверному уменьшению объема повреждения нервной ткани, что объективно зафиксировано с использованием методов МРТ. Сопоставительный анализ различных режимов введения выявил выраженные различия: наибольшая эффективность отмечена при введении 63 мг/кг через 60 мин после нанесения травмы. В этой группе наблюдалось наиболее значимое снижение объема повреждения по сравнению с контролем, что указывает на наличие как дозозависимого, так и временезависимого характера действия лития. Таким образом, результаты подтверждают перспективность использования данного препарата в качестве потенциального нейропротективного средства, особенно в условиях ограниченного терапевтического окна, что имеет прямое значение для последующей трансляции данных в клиническую практику.
Список литературы
1. Oft H. C., Simon D. W., Sun D. New insights into metabolism dysregulation after TBI // Journal of Neuroinflammation. 2024. Vol. 21. https://doi.org/10.1186/s12974-024-03177-6.
2. Сабиров Д. М., Росстальная А. Л., Махмудов М. А. Эпидемиологические особенности черепно-мозгового травматизма // Вестник экстренной медицины. 2019. Т. 12, № 2. С. 61–66.
3. Maas A. I. R., Menon D. K., Manley G. T. et al. Traumatic brain injury: Progress and challenges in prevention, clinical care, and research // The Lancet. Neurology. 2022. Vol. 21, no. 11. P. 1004–1060. https://doi.org/10.1016/s1474-4422(22)00309-x.
4. Graham N. S. N., Zimmerman K. A., Moro F. et al. Axonal marker neurofilament light predicts long-term outcomes and progressive neurodegeneration after traumatic brain injury // Science Translational Medicine. 2021. Vol. 13, no. 613. https://doi.org/10.1126/scitranslmed.abg9922.
5. Мороз В. В., Силачев Д. Н., Плотников Е. Ю. и др. Механизмы повреждения и защиты клетки при ишемии/реперфузии и экспериментальное обоснование применения препаратов на основе лития в анестезиологии // Общая реаниматология. 2013. Т. 9, № 1. С. 63–72. https://doi.org/10.15360/1813-9779-2013-1-63.
6. Гребенчиков О. А., Черпаков Р. А., Евсеев А. К. и др. Влияние хлорида лития на летальность и неврологический дефицит при ишемическом инсульте у крыс // Журнал им. Н. В. Склифосовского «Неотложная медицинская помощь». 2021. Т. 10, № 4. С. 676–686. https://doi.org/10.23934/2223-9022-2021-10-4-676-686.
7. Гребенчиков О. А., Лобанов А. В., Шайхутдинова Э. Р. и др. Кардиопротекторные свойства хлорида лития на модели инфаркта миокарда у крыс // Патология кровообращения и кардиохирургия. 2019. Т. 23, № 2. С. 43–49. https://doi.org/10.21688/1681-3472-2019-2-43-49.
8. Junde Z., Tingting L., Lu Z. et al. Lithium chloride promotes neural functional recovery after local cerebral ischaemia injury in rats through Wnt signalling pathway activation // Folia Morphologica. 2023. Vol. 82. P. 519–532. https://doi.org/10.5603/fm.a2022.0068.
9. Pan H.-Y., Valapala M. Regulation of autophagy by the glycogen synthase Kinase–3 (GSK–3) signaling pathway // International Journal of Molecular Sciences. 2022. Vol. 23, no. 3. https://doi.org/10.3390/ijms23031709.
10. Lu K.-T., Cheng N.-C., Wu C.-Y. et al. NKCC1-mediated traumatic brain injury-induced brain edema and neuron death via Raf/MEK/MAPK cascade // Critical Care Medicine. 2008. Vol. 36, no. 3. P. 917–922. https://doi.org/10.1097/ccm.0b013e31816590c4.
11. Xiao Y., Fan M., Jin W. et al. Lithium chloride ameliorated spatial cognitive impairment through activating mTOR phosphorylation and inhibiting excessive autophagy in the repeated cerebral ischemia-reperfusion mouse model // Experimental and Thera-peutic Medicine. 2020. Vol. 20, no. 5. https://doi.org/10.3892/etm.2020.9237.
12. Черпаков Р. А., Гребенчиков О. А. Влияние концентрации хлорида лития на его нейропротекторные свойства при ишемическом инсульте у крыс // Общая реаниматология. 2021. Т. 17, № 5. С. 101–110. https://doi.org/10.15360/1813-9779-2021-5-101-110.
13. Беда Е. Е., Габитов М. В., Гребенчиков О. А. Влияние ксенона в различных концентрациях на объем поражения головного мозга и выраженность неврологических нарушений у крыс при моделировании открытой черепно-мозговой травмы // Патологическая физиология и экспериментальная терапия. 2024. Т. 68, № 1. С. 26–36. https://doi.org/10.25557/0031-2991.2024.01.26-36.
14. Yu F., Wang Z., Tchantchou F. et al. Lithium ameliorates neurodegeneration, suppresses neuroinflammation, and improves behavioral performance in a mouse model of traumatic brain injury // Journal of Neurotrauma. 2012. Vol. 29, no 2. P. 362–374. https://doi.org/10.1089/neu.2011.1942.
15. Zhu Z.-F., Wang Q.-G., Han B.-J. et al. Neuroprotective effect and cognitive outcome of chronic lithium on traumatic brain injury in mice // Brain Research Bulletin. 2010. Vol. 83, no. 5. P. 272–277. https://doi.org/10.1016/j.brainresbull.2010.07.008.
Об авторах
Д. Т. ШарикадзеРоссия
соискатель
М. В. Габитов
Россия
кандидат медицинских наук, научный сотрудник
О. А. Гребенчиков
Россия
доктор медицинских наук, главный научный сотрудник
В. Т. Долгих
Россия
доктор медицинских наук, профессор, главный научный сотрудник
А. Н. Кузовлев
Россия
доктор медицинских наук, доцент, заместитель директора, руководитель
Рецензия
Для цитирования:
Шарикадзе Д.Т., Габитов М.В., Гребенчиков О.А., Долгих В.Т., Кузовлев А.Н. СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ХЛОРИДА ЛИТИЯ В ДОЗЕ 63 И 21 МИЛЛИГРАММ НА КИЛОГРАММ ЧЕРЕЗ 60 И 180 МИНУТ ПРИ МОДЕЛИРОВАНИИ ЧЕРЕПНО‑МОЗГОВОЙ ТРАВМЫ. Вестник СурГУ. Медицина. 2025;18(3):92-99. https://doi.org/10.35266/2949-3447-2025-3-12
For citation:
Sharikadze D.T., Gabitov M.V., Grebenchikov O.A., Dolgikh V.T., Kuzovlev A.N. COMPARISON OF LITHIUM CHLORIDE EFFECT IN DOSE OF 63 MG/KG AND 21 MG/KG AFTER 60 AND 180 MINUTES IN TRAUMATIC BRAIN INJURY MODELING. Vestnik SurGU. Meditsina. 2025;18(3):92-99. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-12




















