Перейти к:
РЕДКАЯ ЛОКАЛИЗАЦИЯ ПЛАЗМОБЛАСТНОЙ ЛИМФОМЫ У ВИЧ-ИНФИЦИРОВАННОГО ПАЦИЕНТА. МЕХАНИЗМЫ ФОРМИРОВАНИЯ, МЕТОДЫ ДИАГНОСТИКИ
https://doi.org/10.35266/2949-3447-2025-3-10
Аннотация
В рамках настоящего исследования изучены и проанализированы данные, полученные при лучевых методах исследования у 15 ВИЧ-инфицированных пациентов с гистологически верифицированным диагнозом плазмобластная лимфома, проходивших лечение в период с 2014 до 2023 г. в гематологическом отделении Сургутской окружной клинической больницы. В своем исследовании мы получили данные, которые не противоречат обзорам других исследователей. Плазмобластная лимфома развивается у лиц 40–50 лет, злокачественная лимфома впервые диагносцируется на III или IV стадии согласно шкале Анн-Арбор. Для нее характерно поражение ротовой полости, однако нередки случаи поражения желудочно-кишечного тракта. Данный вид лимфомы в 83 % случаев встречается у лиц с выраженной иммуносупрессией. В 100 % случаев выявлена связь с лимфомы с вирусом Эпштейна – Барр.
Для цитирования:
Климова Н.В., Рамзина А.О. РЕДКАЯ ЛОКАЛИЗАЦИЯ ПЛАЗМОБЛАСТНОЙ ЛИМФОМЫ У ВИЧ-ИНФИЦИРОВАННОГО ПАЦИЕНТА. МЕХАНИЗМЫ ФОРМИРОВАНИЯ, МЕТОДЫ ДИАГНОСТИКИ. Вестник СурГУ. Медицина. 2025;18(3):78–84. https://doi.org/10.35266/2949-3447-2025-3-10
For citation:
Klimova N.V., Ramzina A.O. RARE SITE OF PLASMOBLASTIC LYMPHOMA IN HIV‑INFECTED PATIENT. FORMATION MECHANISMS, DIAGNOSTICS METHODS. Vestnik SurGU. Meditsina. 2025;18(3):78–84. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-10
ВВЕДЕНИЕ
Плазмобластная лимфома (ПБЛ) – редкий подтип диффузной В-крупноклеточной лимфомы (ДВКЛ) с высокой аггрессивностью и плохим прогнозом [1]. В 1997 г. H. J. Delecluse и соавт. описали 16 случаев первичной ДВКЛ с поражением ротовой полости с особым иммунофенотипом, из которых 15 случаев были у пациентов с вирусом иммунодефицита человека (ВИЧ), где впервые был предложен диагноз ПБЛ [2]. В 2001 г. ПБЛ была классифицирована как лимфома, ассоциированная с ВИЧ-инфекцией, в классификации лимфоидных опухолей и опухолей кроветворной системы Всемирной организации здравоохранения (ВОЗ) [3]. В 2008 г. классификация лимфоидных опухолей и опухолей кроветворной системы ВОЗ отделила ПБЛ от ДВКЛ и классифицировала его как лимфому, ассоциированную с синдромом приобретенного иммунодефицита (СПИД) [4][5]. В 2016 г. ВОЗ классифицировала ПБЛ как независимый подтип крупноклеточной В-клеточной лимфомы [6], который был связан с инфекциями, вызванными ВИЧ-инфекцией и вирусом Эбола.
Согласно информации ВОЗ за 2023 г. в глобальном масштабе насчитывается около 37,6 миллиона человек, инфицированных ВИЧ, при этом за год было зарегистрировано 1,5 миллиона новых случаев заражения и 690 тысяч смертей, связанных с ВИЧ-инфекцией. ПБЛ составляет примерно 2 % от общего числа лимфом, связанных с ВИЧ [7].
Этиология ПБЛ не ясна. Подобно другим неходжкинским лимфомам, таким как лимфома Беркитта и первичная выпотная лимфома, плазмобластная лимфома имеет тесную связь с вирусом Эпштейна – Барр (ВЭБ) [8][9].
В основе патогенеза плазмобластной лимфомы (ПБЛ) у ВИЧ-инфицированных пациентов, как и при других формах лимфом, лежат четыре основных механизма: продолжительность и степень иммунодефицита или иммуносупрессии; хроническая пролиферация или истощение В-клеток вследствие хронической антигенной стимуляции; потеря иммунного контроля над онкогенными вирусами герпеса, такими как ВЭБ; а также неполное восстановление иммунной системы [10][11]. На этапе установления диагноза у пациентов, инфицированных ВИЧ, средний уровень лимфоцитов типа CD4+ обычно не превышает 200 клеток на миллилитр, а уровень вирусной нагрузки достигает примерно 250 000 копий в одном миллилитре крови [12].
Исследованиями ученых было подтверждено, что фенотипические и морфологические характеристики, отличающие ПБЛ от плазмобластной миеломы, отсутствуют. Для подтверждения диагноза ключевую роль сыграло гистопатологическое исследование с использованием in situ гибридизации ВЭБ [12]. Несмотря на сложность диагностики заболевания, а также высокую резистентность пациентов как с ВИЧ-положительным, так и ВИЧ-отрицательным статусом, специалисты не останавливают поиск и разработку новых эффективных химиотерапевтических препаратов [12][13].
На основании анализа клинических и иммунофенотипических данных гематологами из Китая установлено, что прогностическими факторами являются стадия заболевания, возраст и наличие поражения почек [12]. На территориях с высокой распространенностью ВИЧ-инфекции случаи диагностированной ПБЛ встречаются редко, однако это может быть обусловлено ограниченными возможностями диагностики и не отражать истинную степень распространенности заболевания [11].
Методом выбора в диагностике и дифференциальной диагностике, распространенности процесса, а также навигации для пункционной биопсии, согласно утвержденным клиническим рекомендациям Минздрава Российской Федерации, являются позитронная эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ/КТ), при технической невозможности выполнена компьютерная томография с различными вариантами постпроцессинговой обработки изображения.
В настоящее время не существует достаточно эффективных подходов к лечению ПБЛ, учитывая редкость и особенности заболевания. Наиболее часто применяются СНОР и СНОР-подобные режимы химиотерапии. Обзор литературы демонстрирует, что общий ответ на химиотерапию составляет 77 %, при этом 46 % пациентов достигли полного ответа, а 31 % – частичного ответа [13]. Несмотря на положительный эффект от химиотерапии, средняя выживаемость составляет 14 месяцев, а пятилетняя выживаемость – 31 %. Без лечения выживаемость пациентов с ВИЧ-инфекцией составляет всего 3–4 месяца [13][14].
В данной работе мы представили редкую локализацию плазмобластной лимфомы у ВИЧ-инфицированного пациента.
Цель – на собственных клинических наблюдениях показать особенности диагностики плазмобластной лимфомы у ВИЧ-инфицированных пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
С разрешения локального этического комитета представлены данные, полученные при лучевых методах исследования у 15 ВИЧ-инфицированных пациентов с гистологически верифицированным диагнозом ПБЛ, средний возраст которых составил 46 ± 4 года.
Все 15 пациентов, у которых ранее возникали подозрения на лимфому, обратились за медицинской помощью в больницу. Для них была выполнена компьютерная томография с внутривенным контрастированием головы, шеи, груди, живота и таза в соответствии с утвержденными Минздравом РФ клиническим рекомендациям. Исследование проведено на 128-срезовом аппарате GЕ Optima 660 (USONO). Обработка изображений осуществлялась на мультимодальных рабочих станциях с использованием многовоксельного оборудования и специализированного программного обеспечения, что позволило создавать мультипланарные и криволинейные реконструкции, трехмерные изображения, полученные при мультисрезовой компьютерной томографии (МСКТ), для дальнейшего анализа и интерпретации.
В таблице представлена общая характеристика пациентов с верифицированным диагнозом плазмобластная лимфома. У пациентов с ВИЧ-инфекцией первоначальный диагноз плазмобластной лимфомы зачастую ставится уже на поздних стадиях развития опухоли согласно стандартным критериям классификации по системе Ann Arbor. Обычно это происходит на третьей стадии ВИЧ-инфекции. Плазмобластная лимфома характеризуется преимущественной локализацией вне лимфатических узлов: у 60 % пациентов (9 человек) первичные очаги находились в придаточных пазухах носа, у 33,33 % (5 человек) – в полости рта, и у 6,67 % (1 человек) – в желудочно-кишечном тракте. Кроме того, анализ иммунологических показателей выявил, что развитие ПБЛ связано с высокой и очень высокой вирусной нагрузкой, а также выраженным иммунодефицитом у пациентов. При иммуногистохимическом (ИГХ) исследовании во всех биоптатах лимфомы была выявлена экспрессия ВЭБ-инфекции. Летальный исход был зафиксирован в 100 % случаев, как у ВИЧ-инфицированных, так и иммунокомпетентных пациентов, в результате манифестации и прогрессировании оппортунистических инфекций, которые и явились причиной смерти этих больных.
Таблица
Общая характеристика пациентов с диагнозом плазмобластная лимфома
Анамнез заболевания | ВИЧ-инфицированные пациенты (n = 15) |
Локализация лимфомы | 9 пациентов (60 %) – первичная локализация лимфомы в придаточных пазухах носа; 5 (33,33 %) – в ротовой полости; 1 (6,67 %) – в желудочно-кишечном тракте |
Наличие онкогенных вирусов в анамнезе (ВЭБ, гепатит В, С) | При ИГХ исследовании во всех биоптатах лимфомы была выявлена экспрессия ВЭБ-инфекции |
Объем поражения при первичной диагностике | ПБЛ при первичном лучевом исследовании диагностировались на 4 стадии лимфопролиферативного заболевания |
Количество CD4+ | Выраженный иммунодефицит (200–350 кл/мкл) – 11 пациентов (73,33 %) Умеренный иммунодефицит (350–500 кл/мкл) – 4 пациента (26,67 %) |
Вирусная нагрузка | Высокая (100 тыс. – 500 тыс. копий/мл) – 7 пациентов (46,67 %) Высокая (> 500 тыс. копий/мл) – 8 пациентов (53,33 %) |
Исход | Во всех клинических случаях отмечалось присоединение оппортунистической инфекции, развитие сепсиса. Продолжительность жизни после верифицированного диагноза составила 3–6 месяцев |
Примечание: составлено авторами.
В качестве иллюстрации редкой, нетипичной локализации ПБЛ приводим следующее клиническое наблюдение.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Клиническое наблюдение
Мужчина, 51 г., с диагнозом ВИЧ-инфекция, АРВТ с ноября 2022 г. CD4 –154 кл/мл. Вирусная нагрузка – 175 000 копий/мл. Обратился в поликлинику по месту жительства с жалобами на боли в эпигастральной области, проведена эзофагодуоденоскопия, где по большой кривизне желудка выявлено дополнительное образование, с последующей биопсией. По данным морфологического и ИГХ-исследования: иммуноморфологические показатели соответствовали лимфопролиферативному заболеванию с плазмоклеточной дифференцировкой, которая может соответствовать экстранодальной плазмобластной лимфоме с поражением слизистой оболочки желудка. По данным ИГХ исследования: опухолевые клетки проявляют экспрессию CD38 в 17 % случаев, CD79 а – в 13 %, а ВЭБ (EBV) обнаружен во всех опухолевых клетках (100 %). Также отмечается положительная экспрессия MUM1 у 8 % клеток. Индекс пролиферативной активности Ki-67 составляет примерно 79 %
Для определения объема поражения пациенту проведено комплексное компьютерно-томографическое исследование органов грудной клетки, брюшной полости и забрюшинного пространства, полости малого таза (рис. 1).
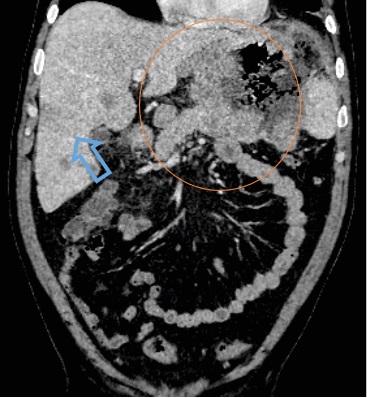
Рис. 1. Компьютерная томография органов брюшной полости: коронарная проекция, где определялось бугристое, диффузное, циркулярное неравномерное утолщение стенок желудка (оранжевый круг). Множественное очаговое поражение печени (синяя стрелка)
Примечание: изображение авторов.
При первичном исследовании на КТ-сканах органов брюшной полости было выявлено образование стенок желудка, вторичное поражение печени, лимфаденопатия парагастральных лимфоузлов. По данным КТ головы, шеи органов грудной полости и полости малого таза данных за вторичное поражение, лимфаденопатию не выявлено.
Пациенту проведен курс химиотерапии по протоколу Hyper-CVAD/НМА, перенес удовлетворительно.
Через месяц перерыва был госпитализирован для следующего курса ХТ.
Для оценки динамики лимфомы проведено повторное комплексное компьютерно-томографическое исследование (рис. 2).
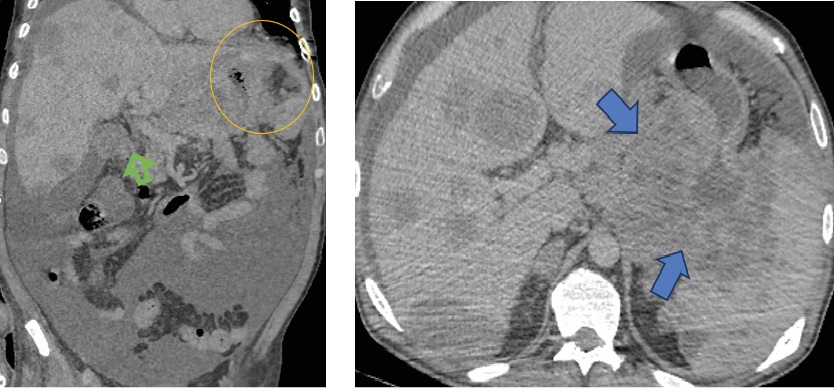
а б
Рис. 2. Компьютерная томография органов брюшной полости: а – коронарная проекция; б – аксиальная проекция.
В динамике увеличение в размерах образования желудка (желтый круг) и распространение в поджелудочную железу и селезенку (синяя стрелка); увеличение в размерах и количестве очагов печени (зеленая стрелка). Асцит
Примечание: изображение авторов.
Во время проведения полихимиотерапии по установленному протоколу у пациента отмечались цитопения, гипокоагуляция, нарушения электролитного баланса и увеличение показателей острой фазы воспаления. В результате у него была диагностирована двусторонняя пневмония (рис. 3).
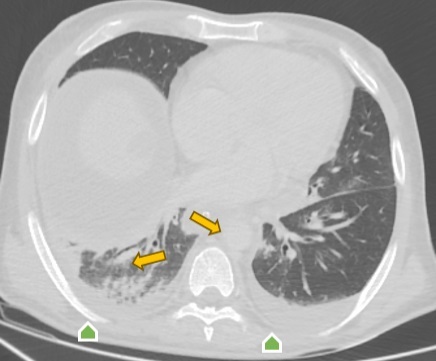
Рис. 3. Компьютерная томография органов грудной клетки в аксиальной проекции:
двусторонняя нижнедолевая пневмония (оранжевая стрелка);
двусторонний гидроторакс (зеленая стрелка)
Примечание: изображение авторов.
В связи с тяжелой полиорганной недостаточностью пациент был переведен в отделение реанимации и анестезии, где, несмотря на проводимую интенсивную терапию, была зафиксирована биологическая смерть.
В приведенном исследовании были обсужденные данные, которые не противоречат обзорам других исследователей, проведенным, в частности, Li Ji-Wei и соавт. (2024 г.), плазмобластная лимфома развивается у лиц 40–50 лет, злокачественная лимфома впервые диагносцируется на III или IV стадии согласно шкале Анн-Арбор. Для нее характерно поражение лицевого отдела черепа, в частности верхней челюсти, придаточных пазух носа. Данный вид лимфомы в 83 % случаев встречается у лиц с выраженной иммуносупрессией. В 100 % случаев выявлена связь лимфомы с ВЭБ-инфекцией.
Сегодня знания об этиологии, клинических симптомах, диагностике и вариантах лечения ПБЛ базируются на небольшом числе зарегистрированных случаев. В 2015 г. J. Castillo и соавт. исследовали 112 случаев ПБЛ у ВИЧ-инфицированных пациентов и пришли к следующим заключениям: заболевание встречается у мужчин в 7 раз чаще и обычно развивается примерно через 5 лет после постановки диагноза ВИЧ. В литературных источниках это одна из самых больших выборок пациентов данной категории. Наиболее частой локализацией ПБЛ являются придаточные пазухи носа и ротовая полость, что показано и в нашем наблюдении. Продемонстрированный клинический случай с локализацией ПБЛ в желудке в литературе представлен в единичных случаях, что указывает на непредсказуемость течения данного заболевания.
Согласно клиническим рекомендациям, утвержденным Минздравом Российской Федерации, пациентам при установлении диагноза ДВКЛ для стадирования и оценки эффекта на терапию рекомендуется выполнить ПЭТ/КТ. Однако при первичном обращении пациента в стационар не все лечебные учреждения имеют такую диагностическую мощность, поэтому в условиях Сургутской окружной клинической больницы для диагностики, дифференциальной диагностики, определения распространенности заболевания, выявления оппортунистических инфекций и проведения навигации при пункционной биопсии предпочтительным методом стала мультисрезовая компьютерная томография с внутривенным контрастированием и применением различных вариантов постобработки изображений. Авторами был разработан алгоритм первичной диагностики плазмобластной лимфомы при отсутствии возможности проведения ПЭТ/КТ в условиях стационара (рис. 4).
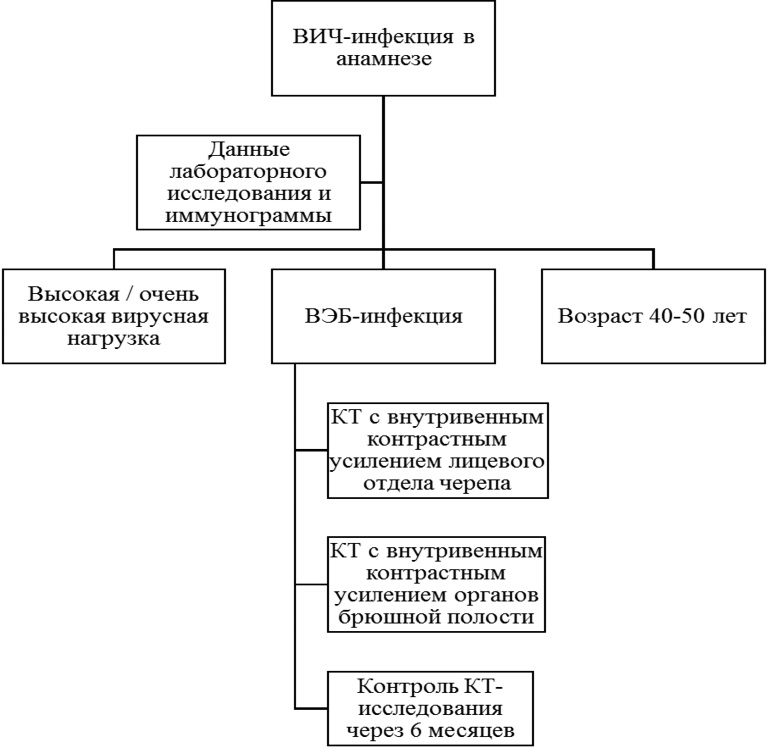
Рис. 4. Алгоритм первичной диагностики плазмобластной лимфомы
Примечание: изображение авторов.
Учитывая преимущественную локализацию лимфомы в челюстно-лицевой области у пациентов с высокой вирусной нагрузкой (> 100 тыс. копий/мл), ВЭБ-инфекцией в анамнезе, даже со стертой клинической картиной, обусловленной множественной оппортунистической инфекцией, компьютерная томография с внутривенным контрастным усилением лицевого отдела черепа и брюшной полости приоритетна при обследовании данной категории больных.
ЗАКЛЮЧЕНИЕ
Учитывая малое количество наблюдений как по данным других исследователей, так и наших наблюдений, редкость и нетипичность локализации ПБЛ требует дальнейшего изучения. Наши данные о ПБЛ у пациентов с ВИЧ, а также обмен клиническим опытом могут помочь в разработке методов для ранней диагностики и улучшения прогноза жизни пациентов. Методикой, способной заподозрить лимфопролиферативное заболевание в максимально ранние сроки, особенно у лиц с ВИЧ-положительным иммунным статусом, является МСКТ с внутривенным контрастным усилением.
Список литературы
1. Попова М. О., Цыганков И. В., Гудожникова Я. В. и др. Плазмобластная лимфома у пациентов с ВИЧ-инфекцией: обзор литературы и результаты российского многоцентрового ретро спективного исследования // Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2022. Т. 15, № 1. С. 28–41. https://doi.org/10.21320/2500-2139-2022-15-1-28-41.
2. Swerdlow S. H., Campo E., Pileri S. A. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms // Blood. 2016. Vol. 127, no. 20. P. 2375–2390. https://doi.org/10.1182/blood-2016-01-643569.
3. Li J.-W., Peng H.-L., Zhou X.-Y. et al. Plasmablastic lymphoma: Current knowledge and future directions // Frontiers in Immunology. 2024. Vol. 15. P. 1–8. https://doi.org/10.3389/fimmu. 2024.1354604.
4. Dolcetti R., Gloghini A., Caruso A. et al. A lymphomagenic role for HIV beyond immune suppression? // Blood. 2016. Vol. 127, no. 11. P. 1403–1409. https://doi.org/10.1182/blood-2015-11-681411.
5. Li Y.-J., Li J.-W., Chen K.-L. et al. HIV-negative plasmablastic lymphoma: Report of 8 cases and a comprehensive review of 394 published cases // Blood Research. 2020. Vol. 55, no. 1. P. 49–56. https://doi.org/10.5045/br.2020.55.1.49.
6. Locke F. L., Go W. Y., Neelapu S. S. Development and use of the ANTI-CD19 chimeric antigen receptor T-cell therapy axicabtagene ciloleucel in large B-cell lymphoma // JAMA Oncology. 2020. Vol. 6, no. 2. P. 281–290. https://doi.org/10.1001/jamaoncol.2019.3869.
7. HIV data and statistics. The World Health Organization. HIV data and statistics. URL: https://www.who.int/teams/global-hiv-hepatitis-and-stis-programmes/hiv/strategic-information/hiv-data-and-statistics (дата обращения: 20.09.2024).
8. Zuze T., Painschab M. S., Seguin R. Plasmablastic lymphoma in Malawi // Infectious Agents and Cancer. 2018. Vol. 13. P. 1–4. https://doi.org/10.1186/s13027-018-0195-4.
9. Castillo J. J., Bibas M., Miranda R. N. The biology and treatment of plasmablastic lymphoma // Blood. 2015. Vol. 125, no. 15. P. 2323–2330. https://doi.org/10.1182/blood-2014-10-567479.
10. Han X., Duan M., Hu L. et al. Plasmablastic lymphoma: Review of 60 Chinese cases and prognosis analysis // Medicine. 2017. Vol. 96, no. 9. P. 1–5. https://doi.org/10.1097/MD.0000000000005981.
11. Lurain K., Ramaswami R., Mangusan R. et al. Use of pembrolizumab with or without pomalidomide in HIV-associated non-Hodgkin’s lymphoma // Journal for Immunotherapy of Cancer. 2021. Vol. 9, no. 2. P. 1–9. https://doi.org/10.1136/jitc-2020-002097.
12. Pretscher D., Kalisch A., Wilhelm M. et al. Refractory plasmablastic lymphoma – A review of treatment options beyond standard therapy // Annals of Hematology. 2017. Vol. 96. P. 967–970. https://doi.org/10.1007/s00277-016-2904-7.
13. Ahn J. S., Okal R., Vos J. A. et al. Plasmablastic lymphoma versus plasmablastic myeloma: An ongoing diagnostic dilemma // Journal of Clinical Pathology. 2017. Vol. 70, no. 9. P. 775–780. https://doi.org/10.1136/jclinpath-2016-204294.
14. Климова Н. В., Гаус А. А., Рамзина А. О. и др. Три аналогичных случая плазмобластной лимфомы у ВИЧ-инфицированных // ВИЧ-инфекция и иммуносупрессия. 2022. Т. 14, № 2. С. 83–90. https://doi.org/10.22328/2077-9828-2022-14-2-83-90.
Об авторах
Н. В. КлимоваРоссия
доктор медицинских наук, профессор, заведующая кафедрой многопрофильной клинической подготовки, заведующая рентгенологическим отделением
А. О. Рамзина
Россия
врач-рентгенолог
Рецензия
Для цитирования:
Климова Н.В., Рамзина А.О. РЕДКАЯ ЛОКАЛИЗАЦИЯ ПЛАЗМОБЛАСТНОЙ ЛИМФОМЫ У ВИЧ-ИНФИЦИРОВАННОГО ПАЦИЕНТА. МЕХАНИЗМЫ ФОРМИРОВАНИЯ, МЕТОДЫ ДИАГНОСТИКИ. Вестник СурГУ. Медицина. 2025;18(3):78–84. https://doi.org/10.35266/2949-3447-2025-3-10
For citation:
Klimova N.V., Ramzina A.O. RARE SITE OF PLASMOBLASTIC LYMPHOMA IN HIV‑INFECTED PATIENT. FORMATION MECHANISMS, DIAGNOSTICS METHODS. Vestnik SurGU. Meditsina. 2025;18(3):78–84. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-10




















