Перейти к:
ЗНАЧИМОСТЬ БИОМАРКЕРОВ И КЛИНИКО‑ИНСТРУМЕНТАЛЬНЫХ ПОКАЗАТЕЛЕЙ В ПРЕДИКЦИИ РАННЕЙ ПРЕЭКЛАМПСИИ ПРИ МНОГОПЛОДНОЙ БЕРЕМЕННОСТИ
https://doi.org/10.35266/2949-3447-2025-3-6
Аннотация
Цель исследования заключалась в оценке прогностической значимости биомаркеров и клинико-инструментальных показателей в I триместре беременности для предикции ранней преэклампсии при многоплодной беременности. Проведен анализ уровней металлопротеиназы с тромбоспондиновыми мотивами типа 5 (ADAMTS‑5), плацентарного фактора роста (PlGF), FMS-подобной растворимой тирозинкиназы‑1 (sFlt‑1), β-субъединицы ХГЧ (β-ХГЧ), ассоциированного с беременностью протеина А (PAPP-A), среднего артериального давления, а также допплерометрических параметров маточных артерий. Установлено, что развитие ранней преэклампсии у пациенток с многоплодной беременностью ассоциировалось со снижением концентраций ADAMTS‑5 и PlGF и повышением соотношения sFlt‑1/PlGF в I триместре. В то же время показатели среднего артериального давления, уровни β-ХГЧ, PAPP-A и sFlt‑1 не имели статистически значимых различий по сравнению с группой пациенток с неосложненным течением многоплодной беременности. Пульсационный индекс маточных артерий характеризовался снижением при развитии ранней преэклампсии. Комбинированная оценка среднего артериального давления, пульсационного индекса маточных артерий, β-ХГЧ, PAPP-A, PlGF и ADAMTS‑5 продемонстрировала значимую прогностическую ценность в отношении ранней преэклампсии при многоплодной беременности. Полученные результаты подтверждают целесообразность применения мультимодальной модели, включающей клинические, биохимические и допплерометрические показатели, для раннего прогнозирования преэклампсии у пациенток с многоплодной беременностью.
Ключевые слова
Для цитирования:
Кудринских И.А., Белоцерковцева Л.Д., Коваленко Л.В., Мордовина И.И. ЗНАЧИМОСТЬ БИОМАРКЕРОВ И КЛИНИКО‑ИНСТРУМЕНТАЛЬНЫХ ПОКАЗАТЕЛЕЙ В ПРЕДИКЦИИ РАННЕЙ ПРЕЭКЛАМПСИИ ПРИ МНОГОПЛОДНОЙ БЕРЕМЕННОСТИ. Вестник СурГУ. Медицина. 2025;18(3):50–59. https://doi.org/10.35266/2949-3447-2025-3-6
For citation:
Kudrinskikh I.A., Belotserkovtseva L.D., Kovalenko L.V., Mordovina I.I. PREDICTIVE VALUE OF BIOMARKERS, CLINICAL AND INSTRUMENTAL PARAMETERS FOR EARLY-ONSET PREECLAMPSIA IN MULTIPLE PREGNANCY. Vestnik SurGU. Meditsina. 2025;18(3):50–59. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-6
ВВЕДЕНИЕ
Преэклампсия (ПЭ) представляет собой многофакторный патологический процесс, специфичный для беременности, с клиническими проявлениями, возникающими после 20-й недели гестации. При этом первичные этапы формирования патологии закладываются еще на ранних сроках беременности (4–5 недель) [1–3]. Внутриклеточные и молекулярные механизмы, определяющие развитие и прогрессирование преэклампсии, остаются недостаточно изученными, что затрудняет ее раннюю предикцию и профилактику тяжелых форм.
Преэклампсия осложняет течение 10–20 % многоплодных беременностей, что в 2–5 раз превышает частоту при одноплодной [4–7]. По данным Сургутского клинического центра охраны материнства и детства, за последние 10 лет частота преэклампсии при многоплодии в пять раз выше по сравнению с одноплодной беременностью. При этом недостаточно данных, подтверждающих идентичность патогенетических механизмов при одноплодной и многоплодной беременности. Считается, что наличие более чем одного плода увеличивает нагрузку на матку и плаценту, формируя относительную плацентарную недостаточность и повышая риск развития преэклампсии [7]. По другим данным, увеличение массы плаценты при многоплодной беременности ассоциировано с усиленной выработкой антиангиогенных факторов, в частности sFlt-1, тогда как морфологические признаки материнской мальперфузии для гипертензивных расстройств у данной категории пациенток выражены в меньшей степени [4][5].
За последние годы накоплены данные, подтверждающие участие воспалительных реакций и процессов окислительного стресса в патогенезе преэклампсии [8][9]. Среди ключевых звеньев этих процессов выделяются металлопротеиназы с тромбоспондиновыми мотивами (ADAMTS), относящиеся к протеолитическим ферментам. Их активация играет значимую роль в регуляции сосудистого ремоделирования спиральных артерий, ангиогенеза, пролиферации и миграции гладкомышечных клеток, апоптоза, репарации тканей и функционирования репродуктивной системы. ADAMTS участвуют в эмбриональном развитии и нейрогенезе, а также могут способствовать развитию сосудистой дисфункции и сердечно-сосудистых заболеваний (гипертензии, атеросклероза, ишемической болезни сердца, сердечной недостаточности, заболеваний периферических артерий, аневризм сосудов) [10].
Ключевым процессом в наступлении и поддержании беременности является плацентация. Успешное формирование плаценты требует трансформации цитотрофобласта и его инвазии в эндометрий и миометрий [11]. Вневорсинчатые трофобласты в процессе миграции утрачивают межклеточные связи и секретируют протеолитические ферменты, в том числе ADAMTS-5, присутствующий в эндометрии с ранних сроков беременности. Экспрессия ADAMTS-5 регулируется цитокинами IL-1β и TGF-β1: первый стимулирует, второй – подавляет ее [12]. ADAMTS-5 участвует в цитокин-опосредованной деградации децидуального внеклеточного матрикса [13].
Снижение экспрессии ADAMTS-5 может приводить к активации провоспалительных процессов и накоплению активных форм кислорода (АФК), что формирует порочный круг воспаления и тканевого повреждения. Наряду с этим активируются митоген-активируемые протеинкиназные (MAPK) пути, вовлеченные в дифференцировку и морфогенез плаценты. Их чрезмерная активация нарушает инвазию трофобласта, усиливает секрецию антиангиогенных факторов: растворимой fms-подобной тирозинкиназы-1 (sFlt-1), растворимого эндоглина (sEng), снижает уровни васкулоэндотелиального фактора роста (VEGF) и плацентарного фактора роста (PlGF), что инициирует развитие преэклампсии [14][15].
Формирование клинических проявлений преэклампсии связано с двумя взаимосвязанными патофизиологическими механизмами: нарушением плацентарной перфузии и ишемией, а также развитием системной эндотелиальной дисфункции у матери. Эти процессы обусловлены системным воспалительным ответом и окислительно-нитритивным стрессом [16][17]. Ключевое значение имеет вовлечение клеток врожденного и адаптивного иммунитета (Т- и В-лимфоцитов, макрофагов, NK-клеток, нейтрофилов), провоспалительных цитокинов и аутоантител [4][18].
Недостаточная инвазия трофобласта снижает плацентарную перфузию, усиливает апоптоз ворсин хориона и образование синцитиальных узелков, что сопровождается поступлением фрагментов трофобластической ткани в материнский кровоток. Это, в свою очередь, усиливает системное воспаление с активацией лейкоцитов, тромбоцитарных мембранных частиц, нейтрофилов, цитокинов, антиангиогенных факторов и гормонов, что усугубляет эндотелиальную дисфункцию и окислительный стресс, приводя к развитию преэклампсии (рис. 1) [19][20].
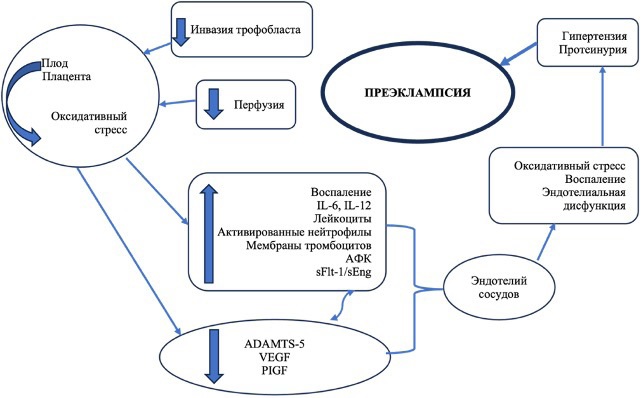
Рис. 1. Механизм развития преэклампсии
Примечание: составлено авторами.
Большинство исследований по прогнозированию преэклампсии посвящено одноплодной беременности; данные по многоплодным беременностям ограничены. В настоящее время для ранней предикции преэклампсии наиболее распространен комбинированный скрининг в I триместре (11–13 + 6 недель), включающий оценку материнских факторов риска, среднего артериального давления, пульсационного индекса маточных артерий и биохимических показателей сыворотки крови (β-субъединицы ХГЧ (β-ХГЧ), протеина ассоциированного с беременностью А (PAPP-A)) в России и включено определение PlGF за рубежом. Ранее было показано, что у пациенток с двойней факторами риска развития гипертензивных осложнений являются первая беременность, избыточная масса тела, семейный анамнез артериальной гипертензии и гипертензивные расстройства в анамнезе [21]. В исследовании Y. Lu и соавт. (2021) установлено, что при многоплодной беременности с преэклампсией чаще встречаются более старший материнский возраст, использование ВРТ и ранние сроки родоразрешения; при этом индекс массы тела, паритет, особенности фетоплацентарного комплекса, семейный анамнез и курение не имели значимого влияния [22].
Известно, что маркеры ангиогенеза PlGF и sFlt-1 связаны с развитием преэклампсии при одноплодной беременности [23][24]. Снижение PlGF и повышение sFlt-1 регистрируются за несколько недель до клинических проявлений и могут быть использованы для скрининга уже в конце I триместра [25]. При одноплодной беременности риск ранней преэклампсии в течение 4 недель высок при значениях sFlt-1/PlGF в диапазоне 38–85 (20–33 недели), тогда как значения < 38 обладают высокой отрицательной прогностической ценностью (99,3 %) в течение 1 недели [26].
Согласно данным De La Calle и соавт., при многоплодии уровни sFlt-1 выше на протяжении всей беременности, а концентрации PlGF сопоставимы или выше таковых при одноплодии [27]. Однако результаты разных исследований относительно пороговых значений sFlt-1/PlGF при многоплодной беременности существенно различаются [28–31].
Таким образом, проблема раннего прогнозирования преэклампсии при многоплодной беременности остается актуальной ввиду высокой частоты осложнений и ограниченности данных о патогенезе данного состояния. Особое внимание заслуживает изучение матриксных металлопротеиназ семейства ADAMTS, в частности ADAMTS-5, участвующих в процессах плацентации, ремоделировании спиральных артерий и регуляции ангиогенеза. Нарушение их экспрессии ассоциировано с воспалением, окислительным стрессом и снижением уровней ангиогенных факторов (PlGF, VEGF), что может играть ключевую роль в развитии преэклампсии. При этом ряд исследований указывает, что при многоплодной беременности, включая ранние формы преэклампсии, морфологические признаки материнской мальперфузии плаценты выражены менее резко, чем при одноплодной гестации, что свидетельствует о неоднородности патогенеза. Следовательно, использование исключительно ангиогенных и антиангиогенных маркеров может быть недостаточным для достоверной предикции у пациенток с многоплодной беременностью. В связи с этим включение ADAMTS-5 – маркера, отражающего ремоделирование внеклеточного матрикса и инвазию трофобласта, а также вовлеченного в регуляцию воспалительного ответа и процессов окислительного стресса, – наряду с PlGF, sFlt-1 и клинико-инструментальными показателями (среднее артериальное давление, пульсационный индекс маточных артерий) представляется перспективным для построения мультимодальной модели ранней предикции преэклампсии при многоплодной беременности.
Цель – оценить прогностическую значимость ADAMTS-5 в сочетании с традиционными маркерами I триместра – показателями материнской гемодинамики (среднее артериальное давление), допплерометрией маточных артерий (пульсационный индекс) и биохимическими показателями сыворотки (β-ХГЧ, PAPP-A, PlGF, соотношение sFlt-1/PlGF) – для ранней предикции преэклампсии при многоплодной беременности в скрининговые сроки 10–13 + 6 недель.
МАТЕРИАЛЫ И МЕТОДЫ
На базе Сургутского окружного клинического центра охраны материнства и детства с 2018 по 2024 г. проводилось наблюдение и обследование беременных с многоплодной беременностью. Все пациентки были разделены на 2 группы исследования. 1-я группа (основная) – 38 пациенток с многоплодной беременностью и развившейся ранней преэклампсией, 2-я группа (контрольная) – 119 пациенток с многоплодной беременностью без клиники преэклампсии. Диагноз преэклампсия устанавливался при сроке гестации от 20 до 34 недель на основании повышения уровня систолического и диастолического артериального давления ≥ 140/90 мм рт. cт., протеинурии ≥ 300 мг/сут за 24 часа или в двух порциях мочи, полученных с шестичасовым промежутком.
У всех пациенток исследуемых групп проводилась оценка анамнеза, клинических факторов риска, жалоб, данных специального акушерско-гинекологического осмотра. С целью предикции преэклампсии в I триместре беременности (10–13 + 6 недель) изучались с помощью иммуноферментного анализа концентрация в сыворотке крови β-субъединицы ХГЧ (β-ХГЧ), ассоциированного с беременностью протеина А (РАРР-А), металлопротеиназы с тромбоспондиновыми мотивами типа 5 (ADAMTS-5), FMS-подобной растворимой тирозинкиназы-1 (sFlt-1), плацентарного фактора роста (PlGF). Для оценки состояния маточно-плацентарного кровотока измерялся пульсационный индекс (ПИ) обеих маточных артерий в импульсном режиме в I триместре, а также среднее артериальное давление.
Статистический анализ данных проводился с использованием пакета прикладных программ IBM SPSS Statistics v.27.
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (М) и стандартных отклонений (SD). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Ме) и нижнего и верхнего квартилей (Q1–Q3).
Сравнение двух независимых групп по количественному признаку проводилось путем проверки статистической гипотезы о равенстве средних рангов с помощью критерия Манна – Уитни. Результаты считали статистически значимыми при p < 0,05.
Построение прогностических моделей риска ПЭ при многоплодной беременности проводился с использованием бинарной логистической регрессии. Для оценки дискриминационной способности количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Эффективность прогностического алгоритма также оценивалась на основе данных о чувствительности и специфичности теста.
Исследование проспективное, одноцентровое. Все пациенты предоставили добровольное информированное согласие на участие до включения в исследование.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно полученным нами данным, в обеих группах пациенток с многоплодной беременностью в I триместре беременности не было выявлено различий по уровням среднего артериального давления. В 1-й группе этот показатель составил 83,00 (78,80–89,80) мм рт. ст., а во 2-й группе – 82,00 (76,00–87,80) мм рт. ст. (р = 0,169).
При анализе результатов лабораторных исследований в 1-й группе пациенток выявлено статистически значимое снижение уровней концентрации в сыворотки крови PlGF (48,60 (23,40–68,40) пг/мл), ADAMTS-5 (2,06 (1,68–2,56) нг/мл) и повышение соотношения sFlt-1/PlGF (62,60 (37,10–72,40) по сравнению со 2-й группой (табл. 1).
Таблица 1
Концентрация молекулярно-биологических маркеров в сыворотке крови в I триместре беременности у обследованных пациенток с многоплодной беременностью
Показатели | 1-я группа n = 38 Me (Q1–Q3) | 2-я группа n = 119 Me (Q1–Q3) | p |
PAPP-A, МоМ | 1,30 (0,76–1,90) | 1,36 (0,99–1,77) | 0,170 |
β-ХГЧ, МоМ | 0,93 (0,61–1,50) | 1,20 (0,59–2,05) | 0,061 |
PlGF, пг/мл | 48,60 (23,40–68,40) | 61,20 (43,50–75,50) | 0,001 |
sFlt-1, пг/мл | 3106 (1454–3977) | 2841 (2393–3327) | 0,553 |
Соотношение sFlt-1/PlGF | 62,60 (37,10–72,40) | 47,20 (25,00–58,00) | 0,003 |
ADAMTS-5, нг/мл | 2,06 (1,68–2,56) | 5,70 (1,93–7,52) | < 0,001 |
Примечание: составлено авторами на основании данных, полученных в исследовании, ADAMTS-5 – металлопротеиназы с тромбоспондиновыми мотивами типа 5, PlGF – плацентарный фактор роста, sFlt-1 – FMS-подобная растворимая тирозинкиназа-1, β-ХГЧ – β-субъединицы ХГЧ, PAPP-A – ассоциированный с беременностью протеин А.
Повышение пульсационного индекса маточных артерий начиная с I триместра беременности при одноплодии считается одним из маркеров предикции преэклампсии [32][33]. Однако, по полученным нами данным у обследованных пациенток с многоплодной беременностью и развитием в последующем преэклампсии этот показатель был статистически значимо ниже, чем в группе без преэклампсии (табл. 2).
Таблица 2
Показатели пульсационного индекса маточных артерий у пациенток с многоплодной беременностью в I триместре
Показатели | 1-я группа n = 38 | 2-я группа n = 119 | p |
ПИ маточных артерий | 1,06 (0,63–1,75) | 1,46 (1,19–1,81) | 0,005 |
Примечание: составлено авторами на основании данных, полученных в исследовании.
Для комплексной оценки индивидуального риска формирования ПЭ при многоплодной беременности было построено несколько прогностических моделей (табл. 3).
Таблица 3
Характеристика и обоснование изучаемых моделей
Модель | Включенные показатели | Обоснование выбора модели |
Модель 1 | Среднее АД ПИ маточных артерий β-ХГЧ PAPP-A | Стандартная модель, используемая в текущий момент времени для одноплодных и многоплодных беременностей |
Модель 2 | Среднее АД ПИ маточных артерий β-ХГЧ PAPP-A sFlt-1/PlGF | В модель добавлено соотношение sFlt-1/PlGF, учитывая статистически различимые показатели, полученные в ходе текущего исследования у исследуемых групп |
Модель 3 | Среднее АД ПИ маточных артерий β-ХГЧ PAPP-A PlGF | К модели 1 добавлено PlGF, учитывая статистически различимые показатели, полученные в ходе текущего исследования у исследуемых групп + данная модель включена в скрининг I триместра при одноплодных беременностях FIGO (International Federation of Gynecology and Obstetrics) и FMF (Fetal Medicine Foundation) |
Модель 4 | Среднее АД ПИ маточных артерий β-ХГЧ PlGF ADAMTS-5 | Инновационная модель, включающая утвержденную схему скрининга I триместра на территории РФ + PlGF – как статистически различимы параметр в исследуемых группах + практика FIGO и FMF и новый маркер ADAMTS-5, статистически значимо различающийся в исследуемых группах |
Примечание: составлено авторами, ADAMTS-5 – металлопротеиназы с тромбоспондиновыми мотивами типа 5, PlGF – плацентарный фактор роста, sFlt-1 – FMS-подобная растворимая тирозинкиназа-1, β-ХГЧ – β-субъединицы ХГЧ, PAPP-A – ассоциированный с беременностью протеин А.
Для модели 1 коэффициент детерминации МакФаддена (R2 McF) составил 0,135. Чувствительность и специфичность модели, а также выбор порога отсечения осуществлены с использованием ROC-анализа. В результате ROC-анализа с опорным уровнем – развитие ПЭ и изменением порога отсечения (точки cut-off) с 0,5 до 0,3 – точность, специфичность и чувствительность модели составили 67,1, 67,3 и 66,7 % соответственно. Площадь под ROC-кривой (AUC) для данной модели составила 0,738 (95 % доверительный интервал (ДИ): 0,579–0,920,
p = 0,007) (табл. 4, рис. 2). Для модели 2 коэффициент детерминации МакФаддена (R2 McF) составил для рассчитанной модели 0,164. Чувствительность и специфичность модели, а также выбор порога отсечения осуществлены с использованием ROC-анализа. В результате ROC-анализа с опорным уровнем – развитие ПЭ и изменением точки cut-off с 0,5 до 0,32 – точность, специфичность и чувствительность модели 2 несколько превосходили аналогичные показатели модели 1 и составили 68,8, 68,6 и 69,2 % соответственно (табл. 4, рис. 3).
Таблица 4
Прогностические меры моделей 1, 2, 3, 4
Модель | Точность | Специфичность | Чувствительность | AUC | OR/95 % ДИ/p | R 2McF |
Модель 1 | 0,671 | 0,673 | 0,667 | 0,738 | 95 % ДИ: 0,579–0,920, p = 0,007 | 0,135 |
Модель 2 | 0,688 | 0,686 | 0,692 | 0,777 | 95 % ДИ: 0,584–0,917, p = 0,006 | 0,164 |
Модель 3 | 0,691 | 0,709 | 0,654 | 0,763 | 95 % CI: 0,613–0,929, р = 0,008 | 0,152 |
Модель 4 | 0,704 | 0,731 | 0,691 | 0,773 | 95 % ДИ: 0,602–0,914, p = 0,009 | 0,169 |
Примечание: составлено авторами на основании данных, полученных в исследовании.
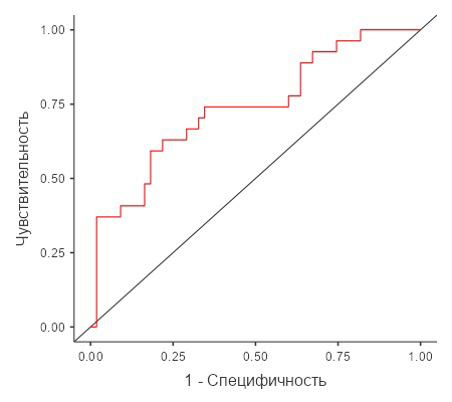
Рис. 2. ROC-кривая для прогностической модели 1
Примечание: составлено авторами на основании данных, полученных в исследовании.
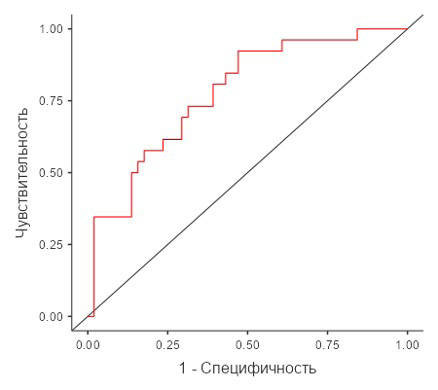
Рис. 3. ROC-кривая для прогностической модели 2
Примечание: составлено авторами на основании данных, полученных в исследовании.
Площадь под ROC-кривой (AUC) для данной модели составила 0,777 (95 % ДИ: 0,584–0,917, p = 0,006), и полученная модель была статистически значимой. Для модели 3, в которую вошли данные пульсационного индекса маточных артерий в первом триместре, среднее АД, уровень β-ХГЧ, PAPP-A и добавлен уровень PlGF, коэффициент детерминации МакФаддена (R2 McF) составил 0,152. В результате ROC-анализа с опорным уровнем – развитие ПЭ и изменением точки cut-off с 0,5 на 0,34 точность, специфичность и чувствительность модели 3 несколько превосходили аналогичные показатели предыдущих двух прогностических моделей и составили 69,1, 70,9 и 65,4 % соответственно. Площадь под ROC-кривой для данной модели составила 0,763 (95 % ДИ: 0,613–0,929, р = 0,008) (табл. 4, рис. 4). В последующем в полученную прогностическую модель 3 в качестве еще одного фактора был добавлен показатель уровня ADAMTS-5. Коэффициент детерминации МакФаддена для разработанной модели был наиболее высоким и составил 0,169. В результате ROC-анализа с опорным уровнем – отсутствие ПЭ и изменением точки cut-off с 0,5 на 0,68 точность, чувствительность и специфичность модели 4 превосходили аналогичные показатели предыдущих прогностических моделей и составили 70,4, 73,1 и 69,1 % соответственно. Площадь под ROC-кривой для данной модели составила 0,773 (95 % ДИ: 0,602–0,914, p = 0,009) (табл. 4, рис. 5).
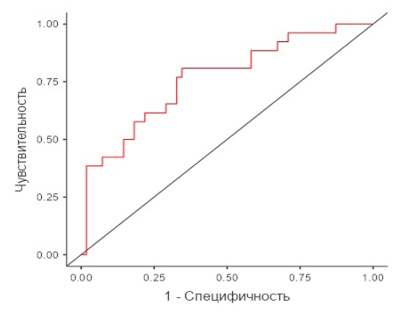
Рис. 4. ROC-кривая для прогностической модели 3
Примечание: составлено авторами на основании данных, полученных в исследовании.
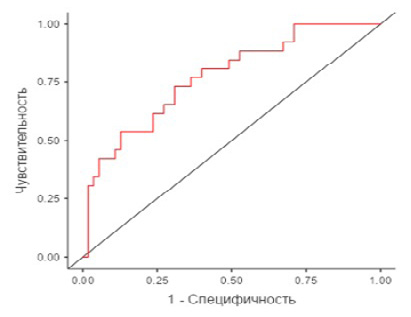
Рис. 5. ROC-кривая для прогностической модели 4
Примечание: составлено авторами на основании данных, полученных в исследовании.
Результаты также отражены в виде графика (рис. 6) и в виде тепловой карты прогностических моделей (рис. 7).
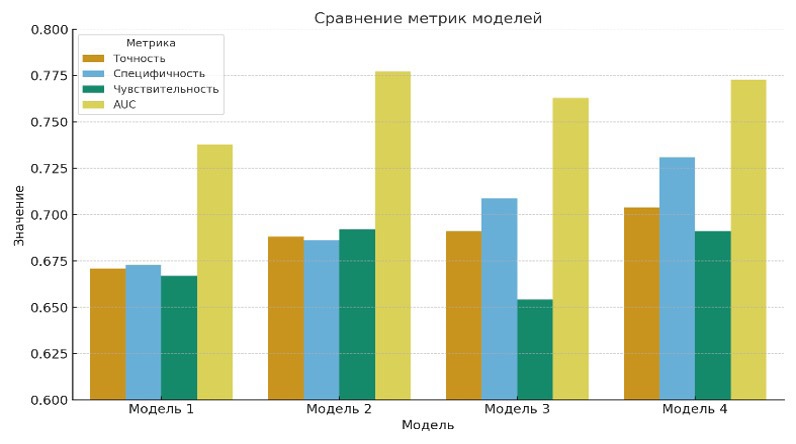
Рис. 6. Сравнение метрик моделей
Примечание: составлено авторами на основании данных, полученных в исследовании.
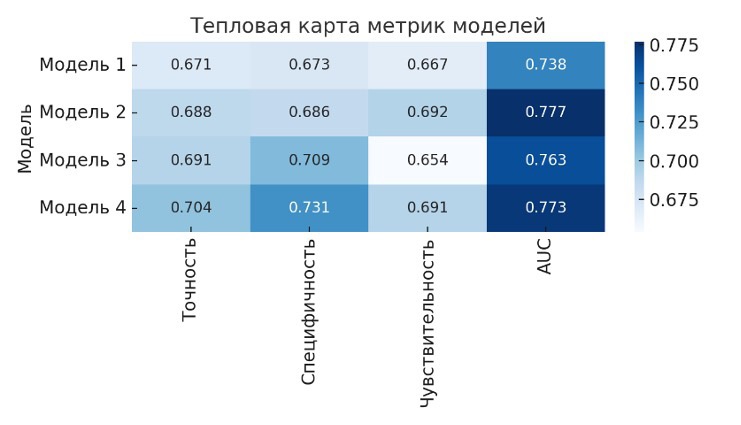
Рис. 7. Тепловая карта метрик моделей
Примечание: составлено авторами на основании данных, полученных в исследовании.
Анализ полученных результатов позволяет сделать вывод о том, что прогностическая модель 4, включающая в себя следующие показатели в I триместре – средний уровень АД, пульсационный индекс маточных артерий, уровень β-ХГЧ, PAPP-A, PlGF и ADAMTS-5, обладает высокой прогностической способностью для оценки риска развития преэклампсии при многоплодной беременности.
ЗАКЛЮЧЕНИЕ
Полученные нами данные подтверждают ассоциацию развития преэклампсии при многоплодной беременности со снижением уровней ADAMTS-5 и PlGF, повышением соотношения sFlt-1/PlGF в I триместре беременности. Тогда как уровни среднего АД, β-ХГЧ, PAPP-A и sFlt-1 в начале беременности не имели значимой разницы в сравнении с протекающей без преэклампсии многоплодной беременности. А показатели пульсационного индекса маточных артерий имели более низкие значения при последующем развитии преэклампсии.
Для отнесения беременных с многоплодной беременностью к высокой группе риска по развитию преэклампсии можно рекомендовать комбинированную оценку среднего АД, пульсационного индекса маточных артерий, β-ХГЧ, PAPP-A, PlGF в сочетании с ADAMTS-5.
Список литературы
1. Erez O., Romero R., Jung E. et al. Preeclampsia and eclampsia: The conceptual evolution of a syndrome // American Journal of Obstetrics & Gynecology. 2022. Vol. 226, no. 2. P. 786–803. https://doi.org/10.1016/j.ajog.2021.12.001.
2. Gusella A., Martignoni G., Giacometti C. Behind the curtain of abnormal placentation in preeclampsia: From molecular mechanisms to histological hallmarks // International Journal of Molecular Sciences. 2024. Vol. 25, no. 14. https://doi.org/10.3390/ijms25147886.
3. Negre-Salvayre A., Swiader A., Salvayre R. et al. Oxidative stress, lipid peroxidation and premature placental senescence in preeclampsia // Archives of Biochemistry and Biophysics. 2022. Vol. 730. https://doi.org/10.1016/j.abb.2022.109416.
4. Белоцерковцева Л. Д., Коваленко Л. В., Кудринских И. А. и др. Роль патоморфологических изменений в плаценте в патогенезе ранней преэклампсии при многоплодии и одноплодии // Вопросы гинекологии, акушерства и перинатологии. 2022. Т. 21, № 4. С. 21–28. https://doi.org/10.20953/1726-1678-2022-4-21-28.
5. Aviram A., Giltvedt M. K., Sherman C. et al. The role of placental malperfusion in the pathogenesis of preeclampsia in dichorionic twin and singleton pregnancies // Placenta. 2018. Vol. 70. P. 41–49. https://doi.org/10.1016/j.placenta.2018.09.002.
6. SMFM Research Committee, Grantz K. L., Kawakita T. et al. SMFM Special Statement: State of the science on multifetal gestations: Unique considerations and importance // American Journal of Obstetrics & Gynecology. 2019. Vol. 221, no. 2. P. B2–B12. https://doi.org/10.1016/j.ajog.2019.04.013.
7. Narang K., Szymanski L. M. Multiple gestations and hypertensive disorders of pregnancy: What do we know? // Current Hypertension Reports. 2021. Vol. 23. https://doi.org/10.1007/s11906-020-01107-4.
8. Tasta O., Swiader A., Grazide M.-H. et al. Role for 4-Hydroxy-2-Nonenal in premature placental senescence in preeclampsia and intrauterine growth restriction // Free Radical Biology and Medicine. 2021. Vol. 164. P. 303–314. https://doi.org/10.1016/j.freeradbiomed.2021.01.002.
9. Herrock O., Deer E., LaMarca B. Setting a stage: Inflammation during preeclampsia and postpartum // Frontiers in Physiology. 2023. Vol. 14. https://doi.org/10.3389/fphys.2023.1130116.
10. Suna G., Wojakowski W., Lynch M. et al. Extracellular matrix proteomics reveals interplay of aggrecan and aggrecanases in vascular remodeling of stented coronary arteries // Circulation. 2018. Vol. 137, no. 2. P. 166–183. https://doi.org/10.1161/circulationaha.116.023381.
11. Mead T. J., Apte S. S. ADAMTS proteins in human disorders //Matrix Biology. 2018. Vol. 71–72. P. 225–239. https://doi.org/10.1016/j.matbio.2018.06.002.
12. Гребенкина П. В., Михайлова В. А., Ошколова А. А. и др. Децидуальные естественные киллеры и клетки трофобласта: клеточные, гуморальные и молекулярные механизмы взаимодействия // Медицинская иммунология. 2022. Т. 24, № 6. С. 1085–1108. https://doi.org/10.15789/1563-0625-DNK-2540.
13. Kosasih H. J., Last K., Rogerson F. M. et al. A disintegrin and metalloproteinase with thrombospondin motifs-5 (ADAMTS-5) forms catalytically active oligomers // Journal of Biological Chemistry. 2016. Vol. 291, no. 7. P. 3197–32208. https://doi.org/10.1074/jbc.m115.704817.
14. McMahon M., Ye S., Izzard L. et al. ADAMTS5 is a critical regulator of virus-specific T cell immunity // PLoS Biology. 2016. Vol. 17, no. 11. https://doi.org/10.1371/journal.pbio.1002580.
15. Huang M. L.-H., Chiang S., Kalinowski D. S. et al. The role of the antioxidant response in mitochondrial dysfunction in degenera-tive diseases: Cross-talk between antioxidant defense, autophagy, and apoptosis // Oxidative Medicine and Cellular Longevity. 2019. Vol. 2019, no. 1. https://doi.org/10.1155/2019/6392763.
16. Фролова Н. И., Белокриницкая Т. Е., Колмакова К. А. Молекулярные маркеры и эпигенетические факторы риска преэклампсии в эпоху предиктивной медицины // Вопросы гинекологии, акушерства и перинатологии. 2019. Т. 18, № 4. С. 95–103. https://doi.org/10.20953/1726-1678-20194-95-103.
17. Rana S., Lemoine E., Granger J. P. et al. Preeclampsia: Pathophysiology, challenges, and perspectives // Circulation Research. 2019. Vol. 124, no. 7. P. 1094–1112. https://doi.org/10.1161/circresaha.118.313276.
18. Melchiorre K., Giorgione V., Thilaganathan B. The placenta and preeclampsia: Villain or victim? // American Journal of Obstetrics & Gynecology. 2022. Vol. 226, no. 2. P. 954–962. https://doi.org/10.1016/j.ajog.2020.10.024.
19. Deer E., Herrock O., Campbell N. et al. The role of immune cells and mediators in preeclampsia // Nature Reviews Nephrology. 2023. Vol. 19. P. 257–270. https://doi.org/10.1038/s41581-022-00670-0.
20. Vaka V. R., McMaster K. M., Cunningham M. W. et al. Role of mitochondrial dysfunction and reactive oxygen species in mediating hypertension in the reduced uterine perfusion pressure rat model of preeclampsia // Hypertension. 2018. Vol. 72, no. 3. P. 703–711. https://doi.org/10.1161/hypertensionaha.118.11290.
21. Taguchi T., Ishii K., Hayashi S. et al. Clinical features and prenatal risk factors for hypertensive disorders in twin pregnancies // Journal of Obstetrics and Gynaecology Research. 2014. Vol. 40, no. 6. P. 1584–1591. https://doi.org/10.1111/jog.12408.
22. Lu Y., Ding Z., Li W. et al. Prediction of twin pregnancy preeclampsia based on clinical risk factors, early pregnancy serum markers, and uterine artery pulsatility index // Pakistan Journal of Medical Sciences. 2021. Vol. 37, no. 7. P. 1727–1733. https://doi.org/10.12669/pjms.37.7.5041.
23. Chaemsaithong P., Gil M. M., Chaiyasit N., et al. Accuracy of placental growth factor alone or in combination with soluble fmslike tyrosine kinase-1 or maternal factors in detecting preeclampsia in asymptomatic women in the second and third trimesters: A systematic review and meta-analysis // American Journal of Obstetrics & Gynecology. 2023. Vol. 229, no. 3. P. 222–247. https:// doi.org/10.1016/j.ajog.2023.03.032.
24. Капустин Р. В., Чепанов С. В., Прохорова В. С. и др. Динамическое исследование маркеров преэклампсии во второй половине гестации у пациенток из групп высокого риска // Вопросы гинекологии, акушерства и перинатологии. 2024. Т. 23, № 2. С. 24–37. https://doi.org/10.20953/1726-1678-2024-2-24-37.
25. Stepan H., Galindo A., Hund M. et al. Clinical utility of sFlt‐1 and PlGF in screening, prediction, diagnosis and monitoring of preeclampsia and fetal growth restriction // Ultrasound in Obstetrics & Gynecology. 2023. Vol. 61, no. 2. P. 168–180. https://doi.org/10.1002/uog.26032.
26. Zeisler H., Llurva E., Chantraine F. et al. Predictive value of the sFlt-1: PlGF ratio in women with suspected preeclampsia // The New England Journal of Medicine. 2016. Vol. 374, no. 1. P. 13–22. https://doi.org/10.1056/nejmoa1414838.
27. De La Calle M., Delgado J. L., Verlohren S. et al. Gestational age-specific reference ranges for the sFlt-1/PlGF immunoassay ratio in twin pregnancies // Fetal Diagnosis and Therapy. 2021. Vol. 48, no. 4. P. 288–296. https://doi.org/10.1159/000514378.
28. Saleh L., Tahitu S. I. M., Danser A. H. J. et al. The predictive value of the sFlt-1/PlGF ratio on short-term absence of preeclampsia and maternal and fetal or neonatal complications in twin pregnancies // Pregnancy Hypertension. 2018. Vol. 14. P. 222–227. https://doi.org/10.1016/j.preghy.2018.03.014.
29. Dröge L., Herraìiz I., Zeisler H. et al. Maternal serum sFlt‐1/PlGF ratio in twin pregnancies with and without pre‐eclampsia in comparison with singleton pregnancies // Ultrasound in Obstetrics & Gynecology. 2015. Vol. 45, no. 3. P. 286–293. https://doi.org/10.1002/uog.14760.
30. Shinohara S., Sunami R., Kasai M. et al. Predictive value of the sFlt-1/PlGF ratio for preeclampsia in twin pregnancies: A retrospective study // Hypertension in Pregnancy. 2021. Vol. 40, no. 4. P. 330–335. https://doi.org/10.1080/10641955.2021.1987455.
31. Martínez-Varea A., Martínez-Sáez C., Domenech J. et al. sFlt-1/PlGF ratio at 24 weeks gestation in twin pregnancies as a predictor of preeclampsia or fetal growth restriction // Fetal Diagnosis and Therapy. 2022. Vol. 49, no. 4. P. 206–214. https://doi.org/10.1159/000525169.
32. Gagliardi G., Tiralongo G. M., LoPresti D. et al. Screening for pre-eclampsia in the first trimester: Role of maternal hemodynamics and bioimpedance in non-obese patients // Ultrasound in Obstetrics & Gynecology. 2017. Vol. 50, no. 5. P. 584–588. https://doi.org/10.1002/uog.17379.
33. Матвеев И. М., Троханова О. В., Сягин А. А. и др. Диагностика преэклампсии на основании показателей скрининга I триместра и компонентов состава тела // Наука молодых (Eruditio Juvenium). 2022. Т. 10, № 1. С. 53–62. https://doi.org/10.23888/HMJ202210153-62.
Об авторах
И. А. КудринскихРоссия
преподаватель, врач – акушер-гинеколог
Л. Д. Белоцерковцева
Россия
доктор медицинских наук, профессор
Л. В. Коваленко
Россия
доктор медицинских наук, профессор
И. И. Мордовина
Россия
кандидат медицинских наук, доцент
Рецензия
Для цитирования:
Кудринских И.А., Белоцерковцева Л.Д., Коваленко Л.В., Мордовина И.И. ЗНАЧИМОСТЬ БИОМАРКЕРОВ И КЛИНИКО‑ИНСТРУМЕНТАЛЬНЫХ ПОКАЗАТЕЛЕЙ В ПРЕДИКЦИИ РАННЕЙ ПРЕЭКЛАМПСИИ ПРИ МНОГОПЛОДНОЙ БЕРЕМЕННОСТИ. Вестник СурГУ. Медицина. 2025;18(3):50–59. https://doi.org/10.35266/2949-3447-2025-3-6
For citation:
Kudrinskikh I.A., Belotserkovtseva L.D., Kovalenko L.V., Mordovina I.I. PREDICTIVE VALUE OF BIOMARKERS, CLINICAL AND INSTRUMENTAL PARAMETERS FOR EARLY-ONSET PREECLAMPSIA IN MULTIPLE PREGNANCY. Vestnik SurGU. Meditsina. 2025;18(3):50–59. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-6




















