Перейти к:
АВТОМАТИЗИРОВАННАЯ ОЦЕНКА МЫШЕЧНОЙ И ЖИРОВОЙ ТКАНИ ПО ДАННЫМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ ДЛЯ НЕИНВАЗИВНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА: ПИЛОТНОЕ ИССЛЕДОВАНИЕ
https://doi.org/10.35266/2949-3447-2025-3-5
Аннотация
Цель исследования – изучить возможности применения показателей жировой и мышечной ткани, определенных по компьютерно-томографическим изображениям органов брюшной полости, полученных с использованием программного обеспечения на основе технологий искусственного интеллекта, для неинвазивной оценки активности воспалительных заболеваний кишечника. Проведено ретроспективное одноцентровое кросс-секционное исследование. Рассмотрены клинико-анамнестические, лабораторные, инструментальные данные пациентов с воспалительными заболеваниями кишечника. Для анализа нативных компьютерно-томографических изображений (уровень середины тела L3 позвонка) использовано программное обеспечение на основе технологий искусственного интеллекта: определены площади поперечного сечения и средняя рентгеновская плотность скелетной мышечной ткани, площади внутримышечной, висцеральной и подкожной жировой ткани. Рассчитаны скелетно-мышечный индекс, доля содержания внутримышечной жировой ткани. Активность заболевания определялась по эндоскопическим, гистологическим и томографическим данным. В исследование включены данные 61 пациента (25 женщин (41 %); 24 пациента с язвенным колитом (39,3 %) и 37 – с болезнью Крона (60,7 %); 50 пациентов в атаке (82 %) и 11 – в ремиссии (18 %)). В группе атаки по сравнению с группой ремиссии выявлено уменьшение площади (p = 0,038) и доли (p = 0,017) внутримышечного жира. По результатам ROC-анализа пороговый уровень для предсказания ремиссии для площади внутримышечного жира составил 3,53 см 2 (AUROC 0,67), для доли – 3,72 % (AUROC 0,71).
Ключевые слова
Для цитирования:
Сморчкова А.К., Васильев Ю.А., Шумская Ю.Ф., Мнацаканян М.Г., Петряйкин А.В., Сенюкова О.В., Бариев А.Н., Куприна И.В., Фоминых Е.В. АВТОМАТИЗИРОВАННАЯ ОЦЕНКА МЫШЕЧНОЙ И ЖИРОВОЙ ТКАНИ ПО ДАННЫМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ ДЛЯ НЕИНВАЗИВНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА: ПИЛОТНОЕ ИССЛЕДОВАНИЕ. Вестник СурГУ. Медицина. 2025;18(3):39–49. https://doi.org/10.35266/2949-3447-2025-3-5
For citation:
Smorchkova А.К., Vasilev Yu.A., Shumskaya Yu.F., Mnatsakanyan M.G., Petraikin A.V., Senyukova O.V., Bariev A.N., Kuprina I.V., Fominykh E.V. AUTOMATED ASSESSMENT OF MUSCLE AND ADIPOSE TISSUE WITH COMPUTED TOMOGRAPHY DATA FOR NON-INVASIVE DETERMINATION OF INFLAMMATORY BOWEL DISEASES ACTIVITY: PILOT STUDY. Vestnik SurGU. Meditsina. 2025;18(3):39–49. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-5
ВВЕДЕНИЕ
Распространенность воспалительных заболеваний кишечника (ВЗК) в России растет, как и во всем мире. Почти за три десятилетия рост числа случаев ВЗК в мире составил 47 %, увеличившись с 3,32 млн в 1990 г. до 4,90 млн в 2019 г. [1]. «Золотым стандартом» оценки активности ВЗК является комплексное обследование, включающее проведение колоноскопии с обязательным гистологическим исследованием слизистой [2]. Тем не менее сложности подготовки, инвазивность процедуры, риски ее выполнения во время тяжелой атаки заболевания, ограничения использования у пациентов без поражения толстой кишки, а также общее негативное отношение пациентов к исследованию заставляют искать неинвазивные способы обследования.
В качестве неинвазивных способов оценки активности заболевания используются как лабораторные, так и инструментальные методы. Традиционные маркеры воспаления, такие как С-реактивный белок, часто неспецифичны, их использование в принятии клинического решения может привести к ошибочному диагнозу или несвоевременному лечению [3]. Современные маркеры, такие как фекальный кальпротектин, обладают более высокой специфичностью, но все еще привносят лишь дополнительную информацию, не являясь определяющими [3]. Из инструментальных высокоинформативны томографические методы исследования, особенно при изолированном поражении тонкой кишки [4]. Однако в контексте оценки состояния тонкой кишки методы лучевой диагностики также имеют свои ограничения: компьютерная томография органов брюшной полости (КТ ОБП) для данной диагностической цели требует обязательного внутривенного (а часто и перорального) контрастирования, несет дополнительную лучевую нагрузку. Магнитно-резонансная энтерография – дорогостоящий метод, а ее широкое использование в практике ограничено необходимостью наличия у врача-рентгенолога специальных знаний и навыков.
От 10 до 85 % пациентов с ВЗК испытывают дефицит питания, при этом распространенность данного состояния варьируется в зависимости от конкретной нозологии и методов оценки нутритивного статуса [5]. Мальнутриция у пациентов с ВЗК является основной причиной потери тощей массы тела – всех органических компонентов организма, не содержащих жир [5]. Аутоиммунное воспаление, присущее ВЗК, приводит к дисбалансу между синтезом и распадом мышечного белка с преобладанием катаболизма. Этот дисбаланс приводит к атрофии мышц и саркопении (патологическое состояние, характеризующееся генерализованным снижением мышечной массы и мышечной силы), особенно в периоды обострения [6]. Оценка состояния мышечной ткани может служить одним из ключей к диагностике обострения заболевания.
Было показано, что состояние жировой ткани также изменяется в зависимости от наличия обострения ВЗК [7]. Атаки ВЗК значительно изменяют характеристики и функции мезентериальной жировой ткани [8], а также приводят к снижению массы жировой ткани и безжировой массы по сравнению с пациентами в стадии ремиссии [9]. Динамика состояния жировой ткани у пациентов с ВЗК также может рассматриваться в качестве маркера обострения заболевания.
КТ ОБП позволяет оценивать не только состояние органов желудочно-кишечного тракта, но и состояние мышечной и жировой тканей на уровне сканирования. Использование для их оценки КТ-изображений, в особенности – с последующей автоматизированной обработкой с помощью программного обеспечения (ПО) на основе технологий искусственного интеллекта (ТИИ) ранее было представлено в литературе для прогнозирования течения ВЗК [10], но возможно также и для расширения дальнейших диагностических возможностей. Привлекательность оценки параметров состава тела при использовании данной методики обусловлена, с одной стороны, возможностью выполнения исследования оппортунистически, т. е. без дополнительного сканирования и без дополнительной лучевой нагрузки, с другой стороны – отсутствием необходимости дополнительных трудозатрат для врача-рентгенолога, интерпретирующего исследование, за счет автоматизации и высокой точности.
Цель – изучить возможности применения показателей жировой и мышечной ткани, определенных по компьютерно-томографическим изображениям органов брюшной полости, полученных с использованием программного обеспечения на основе технологий искусственного интеллекта, для неинвазивной оценки активности воспалительных заболеваний кишечника.
МАТЕРИАЛЫ И МЕТОДЫ
Описание исследования выполнено согласно чек-листу STROBE (The Strengthening the Reporting of Observational Studies in Epidemiology).
Исследования по теме статьи утверждены комитетом по этике государственного бюджетного учреждения здравоохранения города Москвы «Научно-практический клинический центр диагностики и телемедицинских технологий Департамента здравоохранения города Москвы».
Проведено пилотное одноцентровое кросс-секционное исследование, дизайн которого представлен на рис. 1.
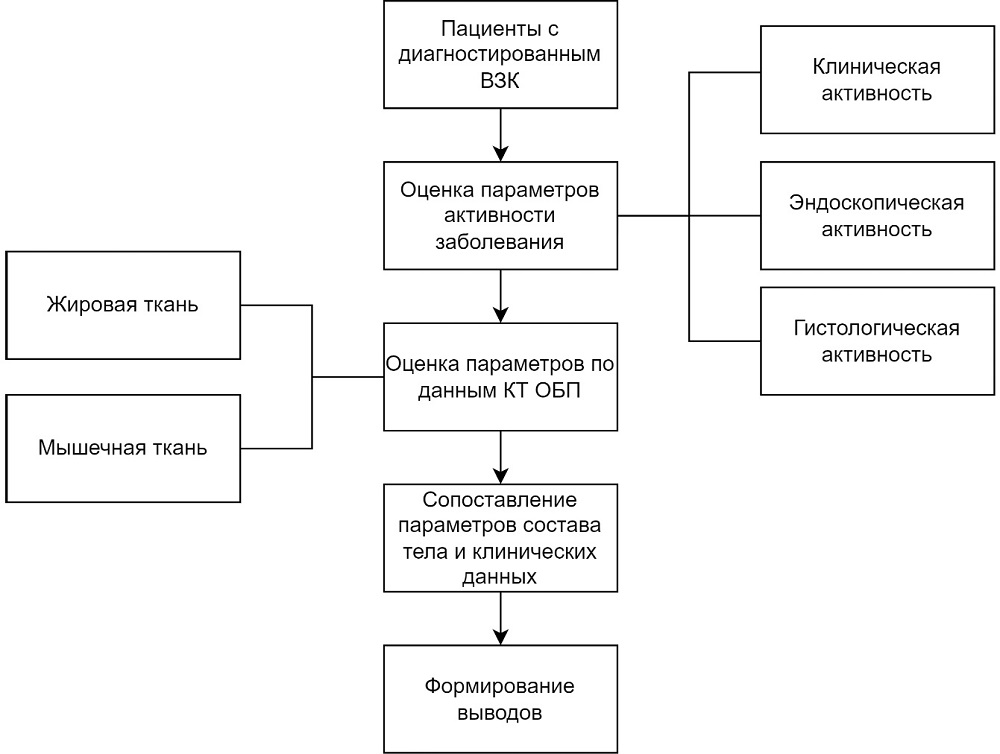
Рис. 1. Дизайн исследования
Примечание: составлено авторами.
Проведен ретроспективный анализ данных пациентов гастроэнтерологического отделения Университетской клинической больницы № 1, находившихся на лечении в период с декабря 2020 г. по июль 2022 г.
Критерии включения:
− возраст от 18 до 75 лет;
− диагноз язвенного колита или болезни Крона, установленный в соответствии с актуальными клиническими рекомендациями [2][11];
− для пациентов с изолированным поражением толстой кишки и/или терминальным илеитом;
− наличие колоноскопии с осмотром терминального отдела с биопсией и гистологическим исследованием;
− для пациентов с изолированным поражением тонкой кишки – наличие магнитно-резонансной (МР) энтерографии;
− наличие данных нативной фазы КТ ОБП.
Критерии невключения:
− поражение верхних отделов желудочно-кишечного тракта;
− обострение или течение сопутствующих заболеваний, которое может повлиять на изменение мышечной массы;
− отсутствие нативной фазы КТ ОБП;
− частичное положение туловища вне поля обзора на КТ-изображениях;
− наличие на КТ-изображениях признаков перорального приема контрастного вещества;
− иные выраженные технические артефакты в поле обзора, затрудняющие интерпретацию и/или автоматическую обработку КТ-изображений.
Учитывая ретроспективный характер исследования, критерии исключения предусмотрены не были.
Компьютерная томография. Всем пациентам выполнялась мультифазная КТ ОБП и малого таза на 640-срезовом томографе Canon Aquilion One Genesis. Исследования проводились с внутривенным введением йодсодержащих водорастворимых контрастных препаратов (йогексол, йопромид) при помощи автоматического болюс-инжектора. Исследование включало нативную, артериальную (на 35–45 с от момента введения контрастного препарата) и порто-венозную (60–80 с) фазы сканирования. Для анализа в данной работе использовалась только нативная фаза. Дополнительные параметры сканирования: исследование проводилось на выдохе при задержке дыхания в положении пациента лежа на спине; диапазон сканирования – от купола диафрагмы до лонного сочленения; напряжение на рентгеновской трубке – 120 кВ; время вращения – 0,5 с; направление – от головы к ногам; коллимация – 50 ×
× 0,5 мм; питч – 0,81, матрица 512 × 512; толщина среза – 1,0 мм.
КТ ОБП для каждого включенного в исследование пациента анонимизированы и обработаны с использованием ранее разработанного ПО на основе ТИИ. Для обработки использовались единичные срезы на уровне середины тела L3 позвонка. Корректность автоматической разметки оценивалась одним врачом-рентгенологом со стажем работы по специальности 3 года. Дополнительно рассчитаны 1 нормализованный и 1 относительный параметры – скелетно-мышечный индекс (СМИ) и доля внутримышечного жира. Пример сегментации алгоритмом КТ изображения на уровне L3 позвонка и автоматически определяемые параметры жировой и мышечной ткани представлены на рис. 2 и в табл. 1.
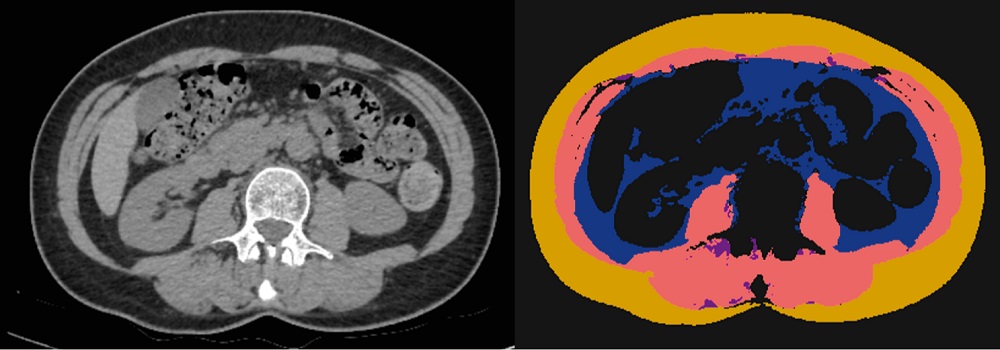
Рис. 2. Пример автоматической сегментации КТ-изображения, выполненной программным обеспечением на основе технологий искусственного интеллекта
Примечание: слева – аксиальный срез на уровне середины тела L3 позвонка в нативной фазе сканирования. Справа – маски автоматической сегментации: розовым – скелетная мышечная ткань (SMA), желтым – подкожная жировая ткань (SFA), синим – висцеральная жировая ткань (VFA), фиолетовым – внутримышечная жировая ткань (IFA). Описание сегментированных областей представлено в табл. 1. Составлено авторами.
Таблица 1
Параметры разметки данных КТ органов брюшной полости
Ткань | Параметр | Единица измерения | Методика измерения |
Жировая | Площадь висцерального жира, | см 2 | Площадь поперечного сечения жировой ткани, расположенной внутри брюшной полости и отграниченной внутренним контуром мышц живота |
Площадь подкожной жировой клетчатки, Subcutaneous Fat Area (SFA) | см 2 | Площадь поперечного сечения жирового ткани, расположенной между кожей и наружным контуром мышц живота | |
Площадь внутримышечной жировой ткани, Intramuscular Fat Area (IFA) | см 2 | Площадь поперечного сечения жировой ткани, расположенной между крупными мышечными волокнами | |
Доля внутримышечного жира | % |
| |
Мышечная | Площадь поперечного сечения скелетных мышц, Skeletal Muscle Area (SMA) | см 2 | Площадь поперечного сечения скелетных мышц |
Скелетно-мышечный индекс (СМИ) | см 2/м 2 | Отношение показателя SMA к квадрату показателя роста пациента, выраженного в метрах | |
КТ-плотность мышечной ткани | HU | Средняя рентгенологическая плотность вокселей скелетных мышц в срезе на уровне третьего поясничного позвонка L3 |
Примечание: составлено авторами.
Программное обеспечение. ПО для автоматизированной разметки мышечной и жировой тканей на КТ-изображениях было разработано на основе ранее представленного прототипа [12] с использованием специально подготовленного набора данных для обучения [13]. ПО реализует две основные задачи: локализация и извлечение необходимого среза для анализа (на уровне середины тела L3 позвонка), а также автоматическая сегментация жировой и скелетной мышечной тканей на полученном срезе на предыдущем этапе.
Алгоритм локализации. На этапе предобработки серия КТ-изображений преобразовывалась в двухмерные изображения с помощью проекции максимальной интенсивности (MIP) во фронтальной плоскости. Размер пикселя полученного MIP-изображения затем нормализовывался до 1 мм, чтобы сохранить постоянное пространственное разрешение. Наконец, значения рентгеновской плотности пикселей были приведены к диапазону «-100, 1500 » HU.
Для локализации среза, соответствующего уровню середины тела L3 позвонка, использовалась техника глубокого обучения с подкреплением (deep reinforcement learning). Для каждой строки изображения рассматривался фрагмент (окно) размером в 200 пикселей с центром на этой строке. Для каждого окна сверточная нейросетевая модель использовалась для предсказания наиболее точного смещения от среза L3 в пределах набора значений «-100, –10, –1, 1, 10, 100». Например, смещение «-10» означает, что срез L3 находится на 10 срезов выше центра текущего окна. Выполнение алгоритма повторяется до тех пор, пока предсказание не сходится к одному окну. Упрощенная схема работы алгоритма представлена на рис. 3.
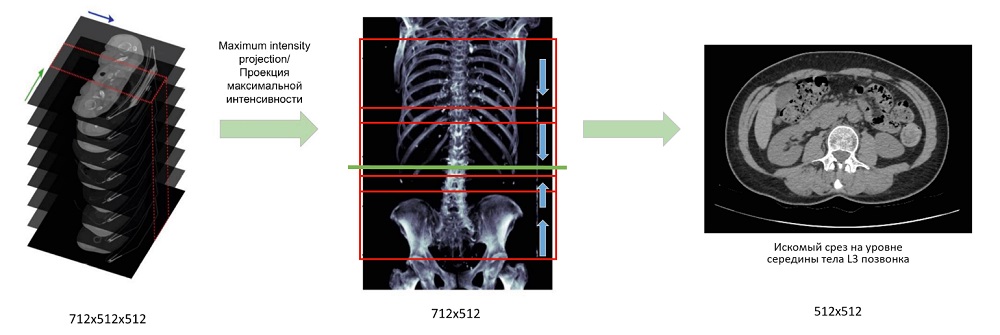
Рис. 3. Упрощенная схема работы алгоритма локализации среза на уровне середины тела L3 позвонка
Примечание: составлено авторами.
Алгоритм сегментации. После выбора среза, соответствующего середине тела L3, значения рентгеновской плотности на нем приводились к диапазону «-500, 500» HU. Затем создавалась сглаженная копия изображения, которая конкатенировалась с исходным и подавалась в сверточную нейронную сеть (CNN). Для CNN была использована архитектура, подобная U-Net. Схема архитектуры представлена на рис. 4.
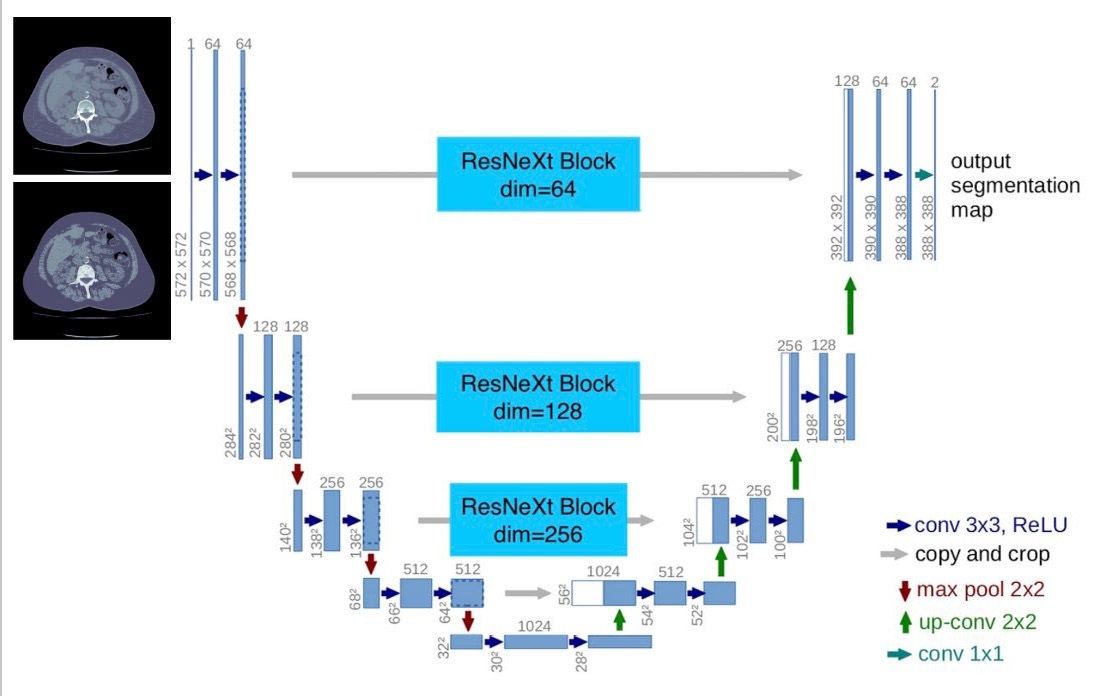
Рис. 4. Схема использованной архитектуры сверточной нейронной сети
Примечание: составлено авторами.
Первый сверточный слой модифицировался для соответствия 2-канальному входу. Пропускные соединения были дополнены адаптерными блоками ResNeXt, что позволяло улучшить качество сегментации в сложных случаях. По результату работы алгоритма создавались PNG-изображения с масками сегментации для скелетной мышечной, подкожной жировой, висцеральной жировой и внутримышечной жировой тканей, а также формировался текстовый отчет со значениями площади данных масок и значением средней рентгеновской плотности скелетной мышечной ткани (рис. 2).
Клинико-инструментальные данные. Активность заболевания рассматривалась с трех позиций: эндоскопическая активность (ЭА, наличие воспаления согласно эндоскопическим методам исследования) и гистологическая активность (ГА, наличие воспалительной инфильтрации или иных признаков активности ВЗК согласно данным гистологического исследования биоптата). Также авторами статьи используется синтетическое понятие «томографическая активность» (ТА), определенное нами как наличие признаков воспаления кишки согласно МР- или КТ-энтерографии, таких как отек, утолщение стенки, накопление контрастного препарата.
В анализе активность указывалась бинарно для каждой категории, также бинарно определялась «общая активность» – если хотя бы один из признаков (ЭА, ГА или ТА) наличествовали, то показатель «общей активности» кодировался как положительный.
По данному критерию пациенты были разбиты на группы сравнения: пациенты в атаке заболевания и в ремиссии.
Обоснование размера выборки. Учитывая пилотный характер и дизайн исследования, минимально необходимый размер выборки составляет 24 пациента [14].
Статистические методы. Для проверки нормальности распределения параметров выборки использован тест Шапиро – Уилка. В зависимости от результатов теста непрерывные переменные будут представлены в виде медианы и межквартильного размаха (Ме [Q1; Q3]), либо в виде среднего значения и среднеквадратичного отклонения (M ± SD). Номинальные переменные описаны в виде процентного соотношения каждого из классов к общей выборке. Номинальные бинарные переменные представлены в виде размера одного из классов и его процентного соотношения с общей выборкой.
Для сравнения между группами по количественным данным был использован t-тест (при нормальном распределении данных) либо критерий Манна – Уитни (при распределении, отличном от нормального). При сравнении групп по номинальным данным был использован точный критерий Фишера.
Для определения наличия, направленности и степени корреляции между оцениваемыми параметрами был произведен расчет коэффициент ранговой корреляции Спирмена.
При выявлении разницы между группами для определения предиктивного порогового значения количественной переменной был использован ROC-анализ с определением J-статистики Юдена.
Анализ данных был выполнен с использованием R версии 4.2.0.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Проанализированы данные 194 пациентов с установленным диагнозом ВЗК. После применения критериев соответствия в исследование включен 61 пациент.
При проведении корреляционного анализа показано, что все оцениваемые в исследовании показатели состава тела демонстрируют достоверные зависимости от показателя индекса массы тела. Положительные корреляции индекса массы тела выявлены для: процента внутримышечного жира, p = 0,39; площади внутримышечного жира (IFA), p = 0,54; скелетно-мышечного индекса (СМИ), p = 0,57. Наиболее сильная положительная связь показана для площади подкожной (p = 0,76) и висцеральной жировой клетчатки (p = 0,77). Отмечена отрицательная корреляция с КТ-плотностью мышечной ткани (p = –0,58), что может быть обусловлено жировой инфильтрацией миоцитов.
Характеристика группы пациентов в атаке заболевания и группы пациентов в ремиссии, а также результаты межгруппового сравнения представлены в табл. 2. У пациентов в атаке заболевания отмечено статистически значимо меньшее количество внутримышечного жира, p = 0,038, а также процента внутримышечного жира, p = 0,017. По остальным показателям пациенты группы атаки заболевания и группа пациентов в ремиссии сопоставимы, p > 0,05. Отмечена тенденция к различию между группами по параметрам СМИ, КТ-плотности мышечной ткани, отношения площади висцеральной жировой ткани к подкожной, p < 0,1.
Таблица 2
Результаты межгруппового сравнения
Параметр | Группа пациентов с атакой, n = 50 | Группа пациентов в ремиссии, n = 11 | p-value |
Половой состав | Женщины – 18 (36 %) Мужчины – 32 (64 %) | Женщины – 7 (64 %) Мужчины – 4 (36 %) | 0,177 |
Представленность нозологий | Язвенный колит – 22 Болезнь Крона – 28 | Язвенный колит – 2 Болезнь Крона – 9 | 0,172 |
Индекс массы тела, кг/м 2 | 23,18 [20,41; 27,21] | 22,04 [19,78; 28,2] | 0,865 |
Возраст, лет | 38,08 ± 11,91 | 41,7 ± 17,45 | 0,221 |
SMA, см 2 (Площадь скелетных мышц) | 140,1 [108,6; 166,7] | 107,7 [93,3; 148,7] | 0,186 |
СМИ, см 2/м 2 (Скелетно-мышечный индекс) | 46,4 ± 9,45 | 42,12 ± 15,74 | 0,068 |
КТ-плотность мышечной ткани, HU | 47 [40; 51] | 41 [32; 50] | 0,094 |
IFA, см 2 * (Площадь внутримышечного жира) | 2,64 [1,17; 4,78] | 3,69 [3; 6,15] | 0,038* |
VFA, см 2 (Площадь висцеральной жировой ткани) | 71,5 [23,3; 131,5] | 73,5 [29,8; 123,4] | 0,466 |
SFA, см 2 (Площадь подкожной жировой ткани) | 103,9 [56,5; 150,3] | 144,1 [91,3; 277,46] | 0,144 |
VFA/SFA (Отношение площади висцеральной к подкожной жировой ткани) | 0,7 [0,4; 1] | 0,5 [0,32; 0,77] | 0,099 |
Процент внутримышечного жира * | 1,9 [0,84; 3,26] | 3,73 [1,79; 5,17] | 0,017* |
Примечание: * – статистически значимые различия. Составлено авторами.
Диагностическая ценность показателей мышечной и жировой ткани у пациентов с ВЗК по данным методик инструментальной диагностики (в т. ч. болезнь Крона) была ранее показана в ряде публикаций. Изменение и соотношение данных показателей отмечены как маркеры для дифференциальной диагностики (болезнь Крона против язвенного колита, атака против ремиссии), а также в качестве предикторов эффективности терапии.
В частности, в работе Z. Xiong и соавт., целью которой являлось создание рентгенологической системы диагностики и протоколирования при ВЗК (IBD-RADS), отношение площади висцеральной к площади подкожной жировой клетчатки является дополнительным диагностическим критерием (наряду с рядом иных показателей), предложенным для дифференциальной диагностики болезни Крона и язвенного колита [15]. В работе S. He и соавт. было показано, что показатели жировой ткани позволяют предсказывать эффективность терапии кортикостероидами у пациентов с ВЗК: так у пациентов с язвенным колитом, имевших ответ на терапию кортикостероидами, отмечены более высокие значения относительной площади жировой ткани (подкожной, висцеральной, мезоректальной), в то время как у аналогичной группы пациентов с болезнью Крона выявлены более низкие показатели висцеральной жировой ткани, индекс брыжеечного жира. Также в данной работе показано, что более выраженная клиническая активность заболевания у пациентов с болезнью Крона ассоциирована с высокими показателями относительной площади тех же типов жировой ткани [16].
В систематическом обзоре литературы C. R. Rowan и соавт. проанализировали 22 публикации с достаточным уровнем доказательности, целью которых было оценить связь между показателями висцеральной жировой ткани и исходами ВЗК. Авторы отметили, что согласно проанализированным исследованиям повышенное содержание висцерального жира было ассоциировано с наличием болезни Крона (в сравнении с пациентами без болезни Крона), повышенным риском наличия сложного фенотипа болезни Крона, а также повышенной вероятностью развития послеоперационного рецидива [17]. Систематический обзор N. S. Ding и соавт., направленный на оценку взаимосвязи изменений показателей оценки состава тела в целом с исходами ВЗК, показал, что пациенты в обострении ВЗК имеют более низкие показатели жировой и безжировой массы тела в сравнении с пациентами в ремиссии [9].
Учитывая имеющиеся литературные обоснованные данные о взаимосвязи параметров состава тела у пациентов с ВЗК с различными исходами, нами была сформулирована гипотеза о возможном предиктивном потенциале количественной оценки мышечной и жировой ткани у пациентов с ВЗК, без деления их на основные нозологические формы (язвенный колит и болезнь Крона). Было предположено, что пациенты с ВЗК в обострении (атаке) имеют сниженные показатели мышечной и жировой тканей в отличие от пациентов в ремиссии.
Главным результатом работы стало доказательство того, что пациенты с ВЗК в обострении и ремиссии действительно отличаются друг от друга по показателям мышечной и жировой ткани, оцененной с использованием алгоритма ИИ по данным нативной КТ ОБП. У пациентов данных групп достоверно различались показатели внутримышечного жира, причем как в абсолютных, так и в процентных значениях (табл. 2). У пациентов в ремиссии медиана площади внутримышечного жира (3,69 см 2), а также процент внутримышечного жира (3,73 %) были выше по сравнению с пациентами в обострении ВЗК: 2,64 см 2 и 2,9 %, соответственно (табл. 2).
Была также отмечена тенденция к более высоким показателям площади подкожного жира, SFA (медиана 144,1 см 2) и висцерального жира, VFA (медиана 73,5 см 2) у пациентов вне обострения по сравнению с пациентами в обострении (103,9 см 2 и 71,5 см 2), однако данные различия оказались недостоверны при выбранном уровне значимости.
Для показателя внутримышечного жира по результатам ROC-анализа пороговый уровень для предсказания ремиссии составил 3,53 см 2, AUROC 0,67 (чувствительность 62 %, специфичность 72,7 %). Для процента внутримышечного жира пороговый уровень 3,72 %, AUROC 0,71 (чувствительность 86 %, специфичность 54,5 %).
Полученные нами данные в целом соответствуют выводам упомянутого ранее систематического обзора N. S. Ding и соавт., за исключением показателей мышечной ткани. Механизм изменения количества внутримышечного жира патофизиологически можно объяснить влиянием циркулирующих цитокинов, которые влияют на постоянно происходящую дифференцировку мезенхимальных клеток-предшественниц в ткани мышц [18]. При этом профиль цитокинов, контролирующих статус внутримышечного жира и цитокинов, играющих роль в патогенезе ВЗК, пересекается [19]. Иными словами, при атаке заболевания отмечается повышение уровня цитокинов, угнетающих формирование пула адипоцитов. Однако данная гипотеза требует дальнейшего исследования.
Мы не использовали категориальное определение скелетно-мышечного индекса СМИ в связи с отсутствием в настоящее время принятых норм для российской популяции, при этом в сравнении с показателями G. Labarthe и соавт. большинство пациентов в нашем исследовании также находились в диагностическом критерии саркопении (менее 38,9 см 2/м 2 для женщин, менее 54,4 см 2/м 2 для мужчин) [20]. Разница в результатах может быть обусловлена тем, что исследование G. Labarthe и соавт. выполнено только на выборке пациентов с болезнью Крона, когда в нашем пилотном исследовании были также пациенты с неспецифическим язвенным колитом.
Считается, что увеличение количества внутримышечной жировой ткани (миостеатоз) отражает миопеническое ожирение и ассоциируется с плохой выживаемостью и более высокой частотой осложнений после хирургических вмешательств у взрослых пациентов [21][22]. Однако данные работы выполнены у пациентов с иными заболеваниями (онкологические заболевания пищеварительной системы, состояние после пересадки печени). Также в нашей работе мы не можем говорить о высоком или низком значении внутримышечной жировой ткани, так как для российской популяции нет нормы, относительно которой мы можем расположить наши результаты. Можно лишь говорить о достоверной разнице между пациентами в обострении и ремиссии ВЗК. В работе S. Bamba и соавт. низкое содержание внутримышечной жировой ткани являлось одним из факторов, ассоциированных с длительным пребыванием в стационаре при болезни Крона [23], т. е. было в целом неблагоприятным фактором, подобно показанному нами. Это может косвенно говорить о более тяжелом течении заболевания у данных пациентов.
КТ ОБП, как было сказано нами ранее, имеет потенциал не только непосредственной оценки органов желудочно-кишечного тракта, но и всех окружающих его структур, в данном случае – скелетной мышечной и жировой ткани, висцеральной и подкожной. В отличие от иных методик оценки состава тела (таких, как биоимпедансный анализ и двухэнергетическая рентгеновская абсорбциометрия), КТ предоставляет наглядную визуализацию макроструктур в поперечном срезе, а также возможность косвенной оценки таких изменений, как миостеатоз. Также КТ (наряду с магнитно-резонансной томографией) является методом «золотого стандарта» диагностики саркопении [24]. Учитывая обязательность выполнения КТ ОБП при госпитализации пациентам с ВЗК, проведения дополнительных инструментальных исследований для оценки состава тела не требуется, т. к. полученные КТ-изображения уже можно использовать для анализа. Одним из наиболее существенных ограничений использования данного метода являлась необходимость ручной разметки поперечного среза на уровне тела L3 позвонка по пороговым значениям HU, что приводило к дополнительным временным и трудовым затратам врача-рентгенолога, интерпретирующего исследование, требовало наличия соответствующего дополнительного навыка, и потому в рутинной практике выполнялось крайне редко или не выполнялось вовсе. Использование разработанного алгоритма на основе ТИИ позволило полностью автоматизировать получение информации о состоянии мышечной и жировой ткани у пациентов с ВЗК, и таким образом получить дополнительную диагностическую информацию при минимуме затраченных ресурсов, с использованием уже полученных данных.
Ограничения исследования. В рамках данного исследования были выявлены ограничения, которые следует учитывать при интерпретации полученных результатов. Первым является пилотный характер, что подразумевает его предварительный статус и ограниченность в масштабах. Также ограничением исследования служит нарушение баланса классов: 50 пациентов находились в состоянии обострения ВЗК, в то время как только 11 пациентов находились в ремиссии. Это может повлиять на анализ различий между группами, однако результаты могут быть полезны для дальнейшего изучения. Несмотря на указанные ограничения, результаты данного пилотного исследования могут послужить основой для дальнейшего научного поиска, направленного на более глубокое понимание проблемы и проверку полученных выводов в более крупных выборках.
ЗАКЛЮЧЕНИЕ
Были оценены перспективы использования показателей жировой и мышечной ткани, получаемые по КТ-изображениям органов брюшной полости с помощью ПО на основе ТИИ, у пациентов с ВЗК. Для определения обострения или ремиссии заболевания значимыми показали себя относительные и абсолютные значения площади внутримышечного жира (увеличение в ремиссии и уменьшение – в атаке). С учетом ограничений настоящего исследования целесообразно дальнейшее изучение прогностической ценности данных показателей на более объемных и сбалансированных выборках.
Список литературы
1. Wang R., Li Z., Liu S. et al. Global, regional and national burden of inflammatory bowel disease in 204 countries and territories from 1990 to 2019: A systematic analysis based on the Global Burden of Disease Study 2019 // British Medical Journal Open. 2023. Vol. 13, no. 3. P. 1–14. https://doi.org/10.1136/bmjopen-2022-065186.
2. Шелыгин Ю. А., Ивашкин В. Т., Белоусова Е. А. и др. Язвенный колит (K51), взрослые // Колопроктология. 2023. Т. 22, № 1. С. 10–44. https://doi.org/10.33878/2073-7556-2023-22-1-10-44.
3. Mosli M., Al Beshir M., Al-Judaibi B. et al. Advances in the diagnosis and management of inflammatory bowel disease: Challenges and uncertainties // Saudi Journal of Gastroenterology. 2014. Vol. 20, no. 2. P. 81–101. https://doi.org/10.4103/1319-3767.129473.
4. Шумская Ю. Ф., Нефедова Т. С., Ахмедзянова Д. А. и др. Скрытое течение болезни Крона: роль томографических методов в диагностике // Digital Diagnostics. 2023. Т. 3, № 4. С. 394–402. https://doi.org/10.17816/DD110952.
5. Scaldaferri F., Pizzoferrato M., Lopetuso L. R. et al. Nutrition and IBD: Malnutrition and/or sarcopenia? A practical guide // Gastroenterology Research and Practice. 2017. Vol. 2017, no. 1. P. 1–11. https://doi.org/10.1155/2017/8646495.
6. Dhaliwal A., Quinlan J. I., Overthrow K. et al. Sarcopenia in inflammatory bowel disease: A narrative overview // Nutrients. 2021. Vol. 13. https://doi.org/10.3390/nu13020656.
7. Michalak A., Kasztelan-Szczerbińska B., Cichoż-Lach H. Impact of obesity on the course of management of inflammatory bowel disease – A review // Nutrients. 2022. Vol. 14, no. 19. P. 1–22. https: // doi.org/10.3390/nu14193983.
8. Weidinger C., Ziegler J. F., Letizia M. et al. Adipokines and their role in intestinal inflammation // Frontiers in Immunology. 2018. Vol. 9. P. 1–7. https://doi.org/10.3389/fimmu.2018.01974.
9. Ding N. S., Tassone D., Al Bakir I. et al. Systematic review: The impact and importance of body composition in inflammatory bowel disease // Journal of Crohn’s and Colitis. 2022. Vol. 16, no. 9. P. 1475–1492. https://doi.org/10.1093/ecco-jcc/jjac041.
10. Ando K., Uehara K., Sugiyama Y. et al. Correlation among body composition parameters and long-term outcomes in Crohn’s disease after anti-TNF therapy // Frontiers in Nutrition. 2022. Vol. 9. P. 1–11. https://doi.org/10.3389/fnut.2022.765209.
11. Шелыгин Ю. А., Ивашкин В. Т., Ачкасов С. И. и др. Клинические рекомендации. Болезнь Крона (К50), взрослые // Колопроктология. 2023. Т. 22, № 3. С. 10–49. https://doi.org/10.33878/2073-7556-2023-22-3-10-49.
12. Сморчкова А. К., Сенюкова О. В., Земцов М. С и др. Прототип алгоритма искусственного интеллекта для автоматической сегментации скелетной мышечной и внутримышечной жировой тканей на КТ-изображениях для оценки состава тела человека // Конгресс Российского общества рентгенологов и радиологов : сб. тезисов. СПб. : Санкт-Петербургская общественная организация «Человек и его здоровье», 2023. С. 203–204.
13. Сморчкова А. К., Петряйкин А. В., Артюкова З. Р. MosMedData: набор диагностических компьютерно-томографических изображений органов брюшной полости на уровне L3 позвонка с сегментацией скелетной мышечной и внутримышечной жировой тканей : свидетельство о государственной регистрации базы данных, охраняемой авторскими правами 2023624494 Рос. Федерация. № 2023624335 ; заявл. от 28.11.2023 ; опубл. 08.12.2023. URL: https://www.elibrary.ru/download/elibrary_56011717_40743539.PDF (дата обращения: 20.02.2025).
14. O’Neill B. Sample size determination with a pilot study // PLoSONE. 2022. Vol. 17, no. 2. P. 1–13. https://doi.org/10.1371/journal.pone.0262804.
15. Xiong Z., Zhang Y., Wu P. et al. Enhancing radiologist’s detection: An imaging-based grading system for differentiating Crohn’s disease from ulcerative colitis // BioMed Central Medicine. 2024. Vol. 22. P. 1–14. https://doi.org/10.1186/s12916-024-03669-5.
16. He S., Huang Y., Peng Y. et al. Association between body fat composition and disease duration, clinical activity, and intravenous corticosteroid-induced response in inflammatory bowel disease // Lipids in Health and Disease. 2023. Vol. 22. P. 1–12. https://doi.org/10.1186/s12944-023-01874-4.
17. Rowan C. R., McManus J., Boland K. et al. Visceral adiposity and inflammatory bowel disease // International Journal of Colorectal Disease. 2021. Vol. 36. P. 2305–2319. https://doi.org/10.1007/s00384-021-03968-w.
18. Vumbaca S., Giuliani G., Fiorentini V. et al. Characterization of the skeletal muscle secretome reveals a role for extracellular vesicles and IL1α/IL1β in restricting fibro/adipogenic progenitor adipogenesis // Biomolecules. 2021. Vol. 11, no. 8. P. 1–22. https://doi.org/10.3390/biom11081171.
19. Vebr M., Pomahačová R., Sýkora J. et al. A narrative review of cytokine networks: Pathophysiological and therapeutic implications for inflammatory bowel disease pathogenesis // Biomedicines. 2023. Vol. 11, no. 12. P. 1–52. https://doi.org/10.3390/biomedicines11123229.
20. Labarthe G., Dolores M., Verdalle-Cazes M. et al. Magnetic resonance imaging assessment of body composition parameters in Crohn’s disease // Digestive and Liver Disease. 2020. Vol. 52, no. 8. P. 878–884. https://doi.org/10.1016/j.dld.2020.06.024.
21. Wang Y., Tian G., Chen S. et al. Myosteatosis reduces overall survival in patients with digestive system malignancies: A metaanalysis with trial sequential analysis // Nutrition Research. 2021. Vol. 94. P. 25–33. https://doi.org/10.1016/j.nutres.2021.08.003.
22. Czigany Z., Kramp W., Bednarsch J. et al. Myosteatosis to predict inferior perioperative outcome in patients undergoing orthotopic liver transplantation // American Journal of Transplantation. 2020. Vol. 20, no. 2. P. 493–503. https://doi.org/10.1111/ajt.15577.
23. Bamba S., Inatomi O., Takahashi K. et al. Assessment of body composition from CT images at the level of the third lumbar vertebra in inflammatory bowel disease // Inflammatory Bowel Diseases. 2021. Vol. 27, no. 9. P. 1435–1442. https://doi.org/10.1093/ibd/izaa306.
24. Cruz-Jentoft A. J., Bahat G., Bauer J. et al. Sarcopenia: Revised European consensus on definition and diagnosis // Age and Ageing. 2018. Vol. 48, no. 1. P. 16–31. https://doi.org/10.1093/ageing/ afy169.
Об авторах
А. К. СморчковаРоссия
младший научный сотрудник, врач-рентгенолог
Ю. А. Васильев
Россия
кандидат медицинских наук, директор
Ю. Ф. Шумская
Россия
врач-гастроэнтеролог, врач-рентгенолог, начальник
М. Г. Мнацаканян
Россия
доктор медицинских наук, профессор, врач-гастроэнтеролог, заведующая
А. В. Петряйкин
Россия
доктор медицинских наук, доцент, главный научный сотрудник, врач-рентгенолог
О. В. Сенюкова
Россия
кандидат физико-математических наук, доцент
А. Н. Бариев
Россия
аспирант, врач-рентгенолог
И. В. Куприна
Россия
кандидат медицинских наук, врач-гастроэнтеролог
Е. В. Фоминых
Россия
кандидат медицинских наук, заведующая, врач-рентгенолог
Рецензия
Для цитирования:
Сморчкова А.К., Васильев Ю.А., Шумская Ю.Ф., Мнацаканян М.Г., Петряйкин А.В., Сенюкова О.В., Бариев А.Н., Куприна И.В., Фоминых Е.В. АВТОМАТИЗИРОВАННАЯ ОЦЕНКА МЫШЕЧНОЙ И ЖИРОВОЙ ТКАНИ ПО ДАННЫМ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ ДЛЯ НЕИНВАЗИВНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА: ПИЛОТНОЕ ИССЛЕДОВАНИЕ. Вестник СурГУ. Медицина. 2025;18(3):39–49. https://doi.org/10.35266/2949-3447-2025-3-5
For citation:
Smorchkova А.К., Vasilev Yu.A., Shumskaya Yu.F., Mnatsakanyan M.G., Petraikin A.V., Senyukova O.V., Bariev A.N., Kuprina I.V., Fominykh E.V. AUTOMATED ASSESSMENT OF MUSCLE AND ADIPOSE TISSUE WITH COMPUTED TOMOGRAPHY DATA FOR NON-INVASIVE DETERMINATION OF INFLAMMATORY BOWEL DISEASES ACTIVITY: PILOT STUDY. Vestnik SurGU. Meditsina. 2025;18(3):39–49. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-5




















