Перейти к:
ПРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ КАЧЕСТВА ТЕХНОЛОГИЙ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА ПРИ АНАЛИЗЕ РЕЗУЛЬТАТОВ МАГНИТНО‑РЕЗОНАНСНОЙ ТОМОГРАФИИ ДЛЯ ВЫЯВЛЕНИЯ И ОЦЕНКИ ОЧАГОВ ДЕМИЕЛИНИЗАЦИИ
https://doi.org/10.35266/2949-3447-2025-3-4
Аннотация
Исследование оценивает качество автоматизированного анализа магнитно-резонансной томографии с использованием искусственного интеллекта для диагностики и мониторинга рассеянного склероза.
Цель исследования – оценить эффективность и точность сервисов искусственного интеллекта в автоматизированном анализе магнитно-резонансной томографии для диагностики и мониторинга рассеянного склероза. Основные задачи включали: проведение проспективного анализа работы двух сервисов искусственного интеллекта в условиях реальной клинической практики; оценку клинической точности и площади под характеристической кривой для каждого сервисов искусственного интеллекта; сравнение качества работы сервисов искусственного интеллекта и их применимости для автоматизированной морфометрии очагов рассеянного склероза.
Работа выполнена в рамках Московского Эксперимента – крупнейшего проспективного исследования искусственного интеллекта в лучевой диагностике. Проанализированы данные магнитно-резонансной томографии 2320 пациентов с помощью двух сервисов искусственного интеллекта. Качество проверялось методом выборочного пересмотра результатов рентгенологами. Статистический анализ проводился с использованием показателей клинической оценки и характеристической кривой. Сервис искусственного интеллекта № 2 показал более высокую точность: клиническая оценка – 91,0 %, AUROC – 0,93. Сервис искусственного интеллекта № 1: клиническая оценка – 81,2 %, AUROC – 0,89. Оба сервиса соответствуют критериям «хорошего» и «высокого» качества, но сервис искусственного интеллекта № 2 продемонстрировал бόльшую стабильность в реальной практике. Технологии искусственного интеллекта применимы для автоматизированного анализа магнитно-резонансной томографии в диагностике и мониторинге рассеянного склероза. Они позволяют снизить субъективность и временные затраты при интерпретации результатов магнитно-резонансной томографии. Сервис искусственного интеллекта № 2 показал лучшие результаты, что делает его более перспективным для внедрения в практическое здравоохранение. Однако необходимы дальнейшие исследования для улучшения стабильности и точности работы сервисов искусственного интеллекта.
Ключевые слова
Для цитирования:
Адамия Н.Д., Владзимирский А.В. ПРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ КАЧЕСТВА ТЕХНОЛОГИЙ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА ПРИ АНАЛИЗЕ РЕЗУЛЬТАТОВ МАГНИТНО‑РЕЗОНАНСНОЙ ТОМОГРАФИИ ДЛЯ ВЫЯВЛЕНИЯ И ОЦЕНКИ ОЧАГОВ ДЕМИЕЛИНИЗАЦИИ. Вестник СурГУ. Медицина. 2025;18(3):29-38. https://doi.org/10.35266/2949-3447-2025-3-4
For citation:
Adamiia N.D., Vladzymyrskyy A.V. PROSPECTIVE STUDY ON ARTIFICIAL INTELLIGENCE TECHNOLOGIES QUALITY IN MAGNETIC RESONANCE IMAGING RESULTS ANALYSIS FOR DETECTION AND ASSESSMENT OF DEMYELINATION LESIONS. Vestnik SurGU. Meditsina. 2025;18(3):29-38. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-4
ВВЕДЕНИЕ
Развитие технологий искусственного интеллекта (ИИ) и компьютерного зрения в последние годы открывает новые возможности для анализа и диагностики медицинских изображений. Эти инновации особенно востребованы в области сложных и многофакторных заболеваний, таких как рассеянный склероз (РС). РС представляет собой хроническое аутоиммунное заболевание, поражающее центральную нервную систему. Это заболевание занимает второе место среди причин стойкой утраты трудоспособности у людей в возрасте от 18 до 44 лет, уступая только последствиям травм [1]. Согласно мировой статистике, в настоящее время зарегистрировано около 2,8 млн случаев РС. В России уровень распространенности заболевания варьируется от 25 до 70 случаев на 100 000 населения, при этом в Москве этот показатель составляет 53 случая на 100 000 человек [2]. РС чаще диагностируется у людей в возрасте от 20 до 40 лет, хотя возможно начало заболевания как в более раннем, так и в более позднем возрасте [3]. Женщины болеют РС в 2–3 раза чаще, чем мужчины, что может быть связано с гормональными и иммунологическими различиями [4]. К факторам риска развития данного патологического состояния относят генетическую предрасположенность, перенесенные вирусные инфекции (например, вирус Эпштейна – Барр), а также экологические, поведенческие и даже алиментарные факторы. Глобально наблюдается тенденция роста заболеваемости рассеянным склерозом [5]. Эффективное лечение рассеянного склероза невозможно без точной и своевременной диагностики и объективной оценки динамики изменений. В контексте сказанного важнейшим инструментом является магнитно-резонансная томография (МРТ). МРТ обеспечивает возможность визуализации участков демиелинизации в белом веществе головного и спинного мозга. Именно посредством данного вида исследований устанавливается наличие диагностических критериев РС Макдональда (2017), базирующихся на выявлении распространения поражений центральной нервной системе в пространстве и времени. С помощью МРТ проводится оценка активности патологического процесса, объективно определяются динамические изменения очагов. Регулярное выполнение магнитно-резонансных исследований чрезвычайно важно для контроля эффективности применяемой терапии, а при необходимости – для ее обоснованной коррекции [6]. Необходимо учитывать, что анализ и интерпретация результатов МРТ – сложная задача, требующая специальной профессиональной подготовки врачей-рентгенологов и значительных временных ресурсов. В условиях постоянного роста количества проводимых лучевых исследований, повышения нагрузки на врачей-рентгенологов, усиления требований к производительности труда и скорости описаний значительно возрастает риск дефектов и даже прямых ошибок. В этом ключе диагностический процесс, связанный с РС, наиболее показателен. Мониторинг течения рассеянного склероза подразумевает проведение регулярных ежегодных МР-исследований, сопровождающихся трудоемким и подверженным ошибкам ручным анализом множественных очагов демиелинизации. Критично важно выявление новых очагов на последовательностях T2/FLAIR, появляющихся между двумя последовательными МРТ. Ведь именно появление новых участков демиелинизации напрямую связано с прогрессированием болезни, неэффективностью терапии, рисками инвалидизации и даже летального исхода. Вместе с тем, в силу изложенных выше факторов, на практике врачи-рентгенологи часто вынуждены ограничиваться приблизительной оценкой изменений. Причина этого состоит в том, что ручная сегментация очагов при РС – это чрезвычайно трудоемкая, утомительная и времязатратная процедура. Кроме того, и она не лишена рисков ошибок. В целом субъективизм и погрешности измерений значительно повышают риски недооценки динамики заболевания и эффективности терапии [7].
Изложенные проблемы потенциально могут быть решены за счет автоматизации измерений и сравнительной оценки очагов демиелинизации. Современной технологией такой автоматизации и является так называемый ИИ, точнее – технологии компьютерного зрения, предназначенные для распознавания и анализа изображений. Сейчас инструменты на основе ИИ для лучевой диагностики активно разрабатываются и изучаются [8][9]. Достаточно перспективны разработки для автоматической сегментации и количественной оценки очаговых поражений головного мозга. Опубликованные алгоритмы обнаруживают и анализируют поражения, оценивают динамику изменений при РС. Появляются инструменты, позволяющие автоматически анализировать различия между последовательными 2D- или 3D-FLAIR МР-изображениями.
Есть публикации, утверждающие преимущества ИИ перед ручной сегментацией. Потенциально автоматизация процесса результатов МРТ в контексте диагностики и мониторинга течения РС может принципиальным образом изменить и улучшить повседневную работу врачей-рентгенологов [10].
Однако на фоне значительного числа публикаций на тему ИИ в лучевой диагностике реальные объемы применения соответствующих продуктов в мире невелики. Подавляющее большинство разработок носят лабораторный характер, не проходят внешнюю объективную проверку и не включаются в клинические исследования [11][12]. Можно сказать, что такие исследования носят математический, а не медицинский характер. На этом фоне в России, в г. Москве с 2020 г. выполняется эксперимент по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения этих технологий в системе здравоохранения (далее – Московский Эксперимент). Это крупнейшее в мире проспективное клиническое научное исследование применимости, безопасности и качества технологий ИИ для лучевой диагностики. В его рамках осуществляется объективное и независимое тестирование и комплексное изучение продуктов на основе ИИ (так называемых ИИ-сервисов) на этапах внедрения и применения в условиях практического здравоохранения (mosmed.ai). Целый ряд продуктов, прошедших многократную проверку и улучшение в рамках Московского Эксперимента, уже получил статус медицинского изделия. С 2023 г. первые медицинские услуги, оказываемые с их применением, получили финансирование за счет средств обязательного медицинского страхования. В 2024 г. лучшие ИИ-сервисы стали доступны для медицинских организаций всей страны за счет запуска платформы «МосМедИИ». Благодаря наличию инфраструктуры и методологий Московского Эксперимента появилась возможность объективно изучать качество и надежность работы ИИ-сервисов в условиях практического здравоохранения.
Цель – оценить в условиях практического здравоохранения качество автоматизированного анализа результатов магнитно-резонансной томографии для выявления признаков рассеянного склероза.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн: многоцентровое проспективное диагностическое исследование согласно методологии репортирования результатов научных исследований диагностических тестов STARD 2015 [13].
Исследование выполнено на материалах лучевых исследований, проведенных в медицинских организациях Департамента здравоохранения г. Москвы (городских поликлиниках) в период 01.01.2023–31.12.2024.
Критерии включения пациентов:
1) мужчины и женщины, старше 18 лет;
2) наличие результатов МРТ головного мозга и МРТ головного мозга с контрастированием, выполненной при оказании плановой медицинской помощи в амбулаторных условиях или в условиях стационара;
3) протокол исследования при МРТ головного мозга: tra T2 tse, tra FLAIR, sag T1 (t)se, tra DWI, tra T2*, cor T2 tse fs (толщина среза ≤ 4 мм); при МРТ головного мозга с контрастированием: tra T2 tse, tra FLAIR (копирование геометрии с T2 tse), tra DWI (копирование геометрии с T2 tse), tra T2* (копирование геометрии с T2 tse), cor T2 tse fs (толщина среза ≤ 4 мм), 3D T1 tra, внутривенное введение МР-контрастного средства, 3D T1 tra (копирование всех параметров 3D T1 tra до введения контраста), tra T1 (t)se fatsat (опционально), FLAIR tra (опционально).
Критерии исключения/невключения в набор данных:
1) двигательные артефакты, артефакты от инородных объектов на уровне исследования;
2) технические дефекты: неверная маркировка исследования, отсутствие необходимых импульсных последовательностей;
3) отсутствие результатов работы ИИ-сервиса или наличие технических дефектов (неполные, искаженные данные).
Индекс-тест (исследуемый метод) – программное обеспечение с применением технологий ИИ (ИИ-сервис), интегрированное в государственную информационную систему в сфере здравоохранения субъекта Российской Федерации – Единый радиологический информационный сервис Единой медицинской информационно-аналитической системы г. Москвы (ЕРИС ЕМИАС). Техническая интеграция выполнена в соответствии с процедурами Московского Эксперимента [14][15]. В исследование включены ИИ-сервисы – независимые участники Московского Эксперимента:
– IMV–MS (ООО «ИМВИЖН»);
– NtechMed MRI Brain (ООО «НТех лаб»).
В тексте статьи ИИ-сервисы анонимизированы для обеспечения беспристрастности и объективности.
В рамках Московского Эксперимента сформулирована стандартизированная задача для ИИ.
- Выявить МР-признаки рассеянного склероза:
– для МРТ без контрастного усиления наличие ≥ 1 гиперинтенсивного очага демиелинизации не менее 3 мм по длинной оси на T2 и/или FLAIR двух или более локализаций: юкстакортикальные или субкортикальные, перивентрикулярные, инфратенториальные (критерии McDonald [16]);
– для МРТ с контрастным усилением: наличие ≥ 1 очага, накапливающих контрастное вещество, на постконтрастных T1-изображениях.
- Сформировать ответ, содержащий:
– вероятность наличия РС;
– контур очагов демиелинизации с цветовой дифференциацией по локализациям: юкстакортикальные и субкортикальные – розовый, перивентрикулярные – желтый, инфратенториальные – голубой;
– общее количество очагов демиелинизации на бесконтрастных сериях;
– отметку очагов, накапливающих контрастное вещество;
– количество очагов, накапливающих контрастное вещество, на серии с контрастированием;
– общий объем очагов демиелинизации;
– объем очагов демиелинизации в каждой из локализаций (юкстакортикальная и субкортикальная, перивентрикулярная, инфратенториальная).
Референс-тест: мониторинг для клинической оценки качества работы ИИ-сервиса по оригинальной методике, которая была разработана и валидирована в процессе Московского Эксперимента [17]. Мониторинг включает следующие аспекты.
- Формирование случайным образом выборки из всего объема проанализированных ИИ-сервисом результатов МРТ за отчетный период (1 месяц). Размер выборки, достаточный для значимого контроля, обоснован ранее и составляет 80 исследований [18]. Соответственно ежемесячно случайным образом формируется выборка из результатов 80 МРТ головного мозга.
- Пересмотр выборки двумя врачами-рентгенологами с компетенциями в анализе МРТ и со стажем работы не менее 5 лет.
- Оценка результатов автоматизированного анализа каждого исследования по двум критериям:
– корректность определения и маркировки локализации патологических проявлений (маркировка ИИ-сервисом);
– правильность трактовки ИИ-сервисом результатов лучевого исследования (заключение ИИ-сервиса).
Варианты оценки: полное соответствие (1 балл), некорректная оценка (0,5 балла), ложноположительный результат (0,25 балла), ложноотрицательный результат (0 баллов).
- Каждый эксперт для каждого исследования определяет одну возможную оценку. Все полученные таким образом баллы суммируются. Для данной выборки максимально возможное значение суммы баллов принимается за 100,0 %. Исходя из этого определяется удельный вес начисленной экспертами суммы баллов. Он и является уровнем клинической оценки, изменяющейся в диапазоне от 0,0 до 100,0 %.
Данные МРТ деперсонализированы в соответствии с законодательством Российской Федерации.
Длительность работы включенных в исследование ИИ-сервисов в Московском Эксперименте была разной, соответственно различалось и количество проведенных мониторингов. Суммарный размер выборки для ИИ-сервиса № 1 составил 720 результатов МРТ, для ИИ-сервиса № 2–1600.
Размер выборки составил 400 случаев за каждый период наблюдения. Он обоснован в ранее опубликованной с нашим участием статье [19], а также принят в качестве обязательного и достаточного в соответствии с нормативно-правовыми актами, регулирующими проведение Московского Эксперимента. Сравнение средних проводили с применением t-критерия Стьюдента. Определяли показатели: клиническую оценку для данного ИИ-сервиса за месяц и за весь период наблюдения; площадь под характеристической кривой (далее – AUROC от англ. area under receiver operating characteristic curve [20]). Интерпретация значений: менее 0,7 (70,0 %) – неприемлемое, 0,7–0,8 (70,0–80,0 %) – приемлемое, 0,81–0,9 (81,0–90,0 %) – хорошее, более 0,9 (90,0 %) – высокое качество [21]. Использована описательная статистика с применением программного обеспечения MedCalc 20.104.
Исследование проведено в рамках Эксперимента по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения в системе здравоохранения г. Москвы, утвержденного этическим комитетом (выписка из протокола № 2 НЭК МРО РОРР от 20 февраля 2020 г.) и зарегистрированного на ClinicalTrials (NCT04489992).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В таблице представлена описательная статистика показателей клинической оценки и площади под характеристической кривой обоих включенных в исследование ИИ-сервисов. Динамика показателей отражена на рис. 1–2.
Таблица
Описательная статистика показателей качества ИИ-сервисов для автоматизированного анализа результатов МРТ с целью выявления и измерений признаков рассеянного склероза
Показатель | Клиническая оценка | AUROC | ||
ИИ-1 | ИИ-2 | ИИ-1 | ИИ-2 | |
N | 720 | 1600 | 720 | 1600 |
Среднее | 81,2 | 91,0 | 0,89 | 0,93 |
SD | 8,0 | 7,5 | 0,05 | 0,05 |
95 % доверительный интервал | 80,6; 81,8 | 90,6; 91,4 | 0,886; 0,894 | 0,928; 0,932 |
Минимальное | 62,5 | 76,0 | 0,82 | 0,86 |
Максимальное | 90,3 | 99,0 | 0,95 | 0,99 |
Медиана | 82,4 | 94,0 | 0,9 | 0,94 |
Q1 | 81,3 | 86,2 | 0,85 | 0,89 |
Q3 | 86 | 97 | 0,92 | 0,97 |
t-критерий (p) | 3,163 (0,004) | 1,977 (0,0587) | ||
Примечание: составлено авторами.
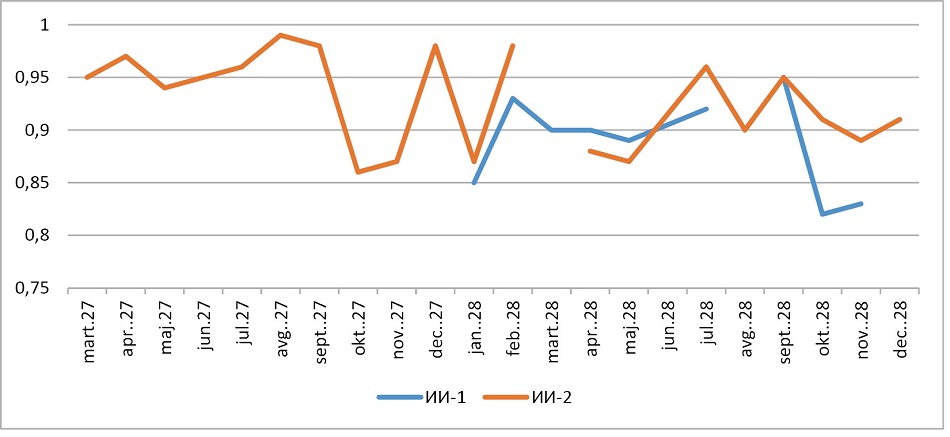
Рис. 1. Динамика клинической оценки ИИ-сервисов для автоматизированного анализа результатов МРТ
с целью выявления и измерений признаков рассеянного склероза
Примечание: составлено авторами.
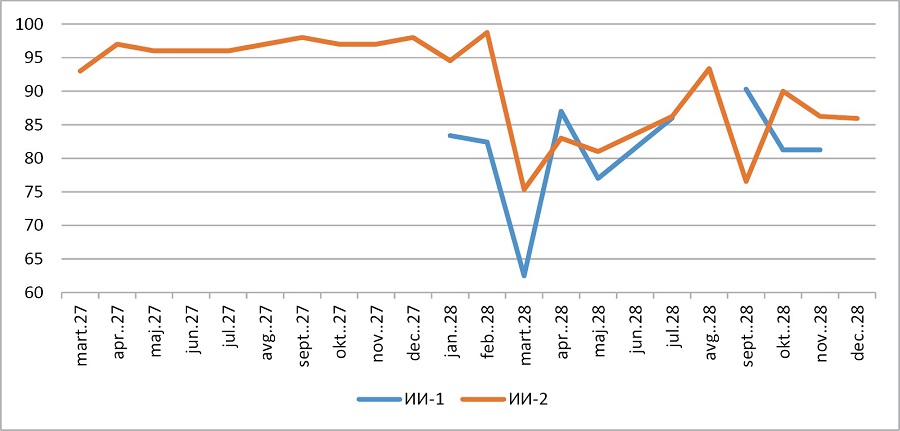
Рис. 2. Динамика площади под характеристической кривой ИИ-сервисов для автоматизированного анализа результатов МРТ
с целью выявления и измерений признаков рассеянного склероза
Примечание: составлено авторами.
Для ИИ-сервиса № 1 период наблюдения составил 9 месяцев 2024 г., соответственно в выборку вошло 720 наблюдений. Среднее значение клинической оценки колебалось в диапазоне от 62,5 % (в марте 2024 г.) до 90,3 % (в октябре 2024 г.). В большинстве периодов оценка была ниже 90,0 %, за исключением только одного упомянутого выше периода. Среднее значение клинической оценки ИИ-сервиса № 1 составило 81,2 % (95 % доверительный интервал (ДИ) 80,6; 81,8). Наивысшее значение AUROC, составившее 0,95, достигнуто в октябре; наименьшее – 0,82 – в ноябре. Суммарно за весь период наблюдения среднее значение AUROC для ИИ-сервиса № 1 составило 0,89 (95 % ДИ 0,886; 0,894). Средние значения обоих показателей интерпретируются как хорошие, следовательно, ИИ-сервис № 1 в условиях применения в практическом здравоохранении демонстрирует хороший уровень качества.
Для ИИ-сервиса № 2 период наблюдения составил 20 месяцев – 2023 и 2024 гг., соответственно, в выборку включено 1600 наблюдений. Значение клинической оценки колебалось в диапазоне от 76,0 % (в марте 2024 г.) до 99,0 % (в феврале 2024 г.). В большинстве периодов оценка была выше 90,0 %, за исключением лишь трех периодов (марта, апреля и сентября 2024 г.).
Среднее значение клинической оценки за 2023 г. составило 96,6 %, в 2024 г. оно несколько снизилось до 86,5 %. Суммарно для ИИ-сервиса № 2 клиническая оценка составила 91,0 % (95 % ДИ 90,6; 91,4).
Этим же продуктом наивысшее значение AUROC, составившее 0,99, достигнуто в августе 2023 г.; наихудший результат отмечен в октябре того же года – 0,86. Тем не менее в большинстве периодов значения площади под характеристической кривой для ИИ-сервиса № 2 превышали 0,90. Среднее значение AUROC за 2023 г. составило 0,95, за 2024 г. – 0,91. Суммарно за весь период наблюдения среднее значение AUROC для ИИ-сервиса № 2 составило 0,93 (95 % ДИ 0,928; 0,932).
Средние значения обоих показателей интерпретируются как высокие, следовательно, ИИ-сервис № 2 в условиях применения в практическом здравоохранении демонстрирует высокий уровень качества.
При сравнении алгоритмов обращают на себя внимание различия в клинической оценке: у ИИ-сервиса № 1 медиана меньше (82,4 против 94,0 %), а исходя из значений первого и третьего квартилей большинство значений его клинической оценки попадают в худший диапазон. Средние значения клинической оценки ИИ-сервисов № 1 и № 2 статистически значимо различаются (р = 0,004).
Таким образом, ИИ-сервис № 2 за весь период наблюдения продемонстрировал более высокое качество своей работы: среднее значение и медиана клинической оценки значимо выше, а половина результатов мониторинга попадает в диапазон от Q1 = 86,2 до Q3 = 97 (в то время как у ИИ-сервиса № 1 этот диапазон составляет 81,3–86).
Вместе с тем при рассмотрении ситуации в динамике видно, что ИИ-сервис № 2 склонен к некоторой нестабильности. В 2023 г. он демонстрировал высокий уровень клинической оценки, а в 2024 г. произошло сильное падение этого показателя; в дальнейшем же он оставался нестабильным. ИИ-сервис № 2 также отличается явной нестабильностью клинической оценки.
В отношении площади под характеристической кривой ситуация более сбалансирована. Среднее значение ИИ-сервиса № 2 несколько выше, но статистической значимости различие не достигает (хотя и находится почти на границе). Значения первого и третьего квартилей, медианы лучше, но всего на сотые доли. Оценка в динамике также свидетельствует о нестабильности: AUROC значительно колеблется от периода к периоду у обоих ИИ-сервисов.
Кроме того, стоит отметить, что динамические колебания не связаны с «выходом» ИИ-сервиса № 2 за пределы оценок качества «хорошее» и «высокое», а ИИ-сервис № 1 лишь однократно опустился до «приемлемого», после вернувшись к «хорошему».
На рис. 3–4 представлены примеры работы ИИ-сервисов, визуализируются очаги поражения головного мозга, характерные для РС. На рис. 3 очаги дифференцированы по локализации и выделены цветами для удобства интерпретации:
– инфратенториальные очаги (голубой цвет);
– перивентрикулярные очаги (желтый цвет);
– субкортикальные очаги (красный цвет);
– юкстакортикальные очаги (розовый цвет).
На серии T1 с контрастированием активных очагов с накоплением контрастного вещества не обнаружено, что может свидетельствовать об отсутствии активного воспалительного процесса на момент исследования. Вероятность патологии, связанной с рассеянным склерозом, оценивается как 99 %.
На рис. 4 очаги дифференцированы по локализации и выделены цветами для удобства интерпретации:
– юкстакортикальные и субкортикальные очаги (розовый цвет);
– перивентрикулярные очаги (желтый цвет);
– инфратенториальные очаги (голубой цвет).
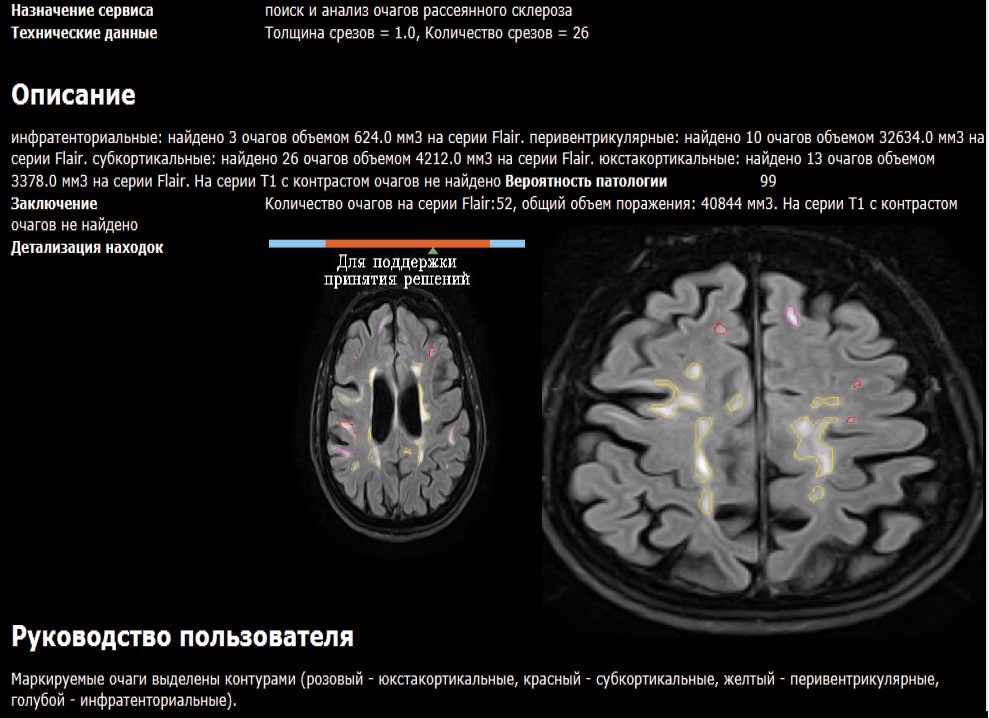
Рис. 3. Примеры работы ИИ-сервиса 2: девушка, 35 лет, верифицированный диагноз – РС
Примечание: составлено авторами.
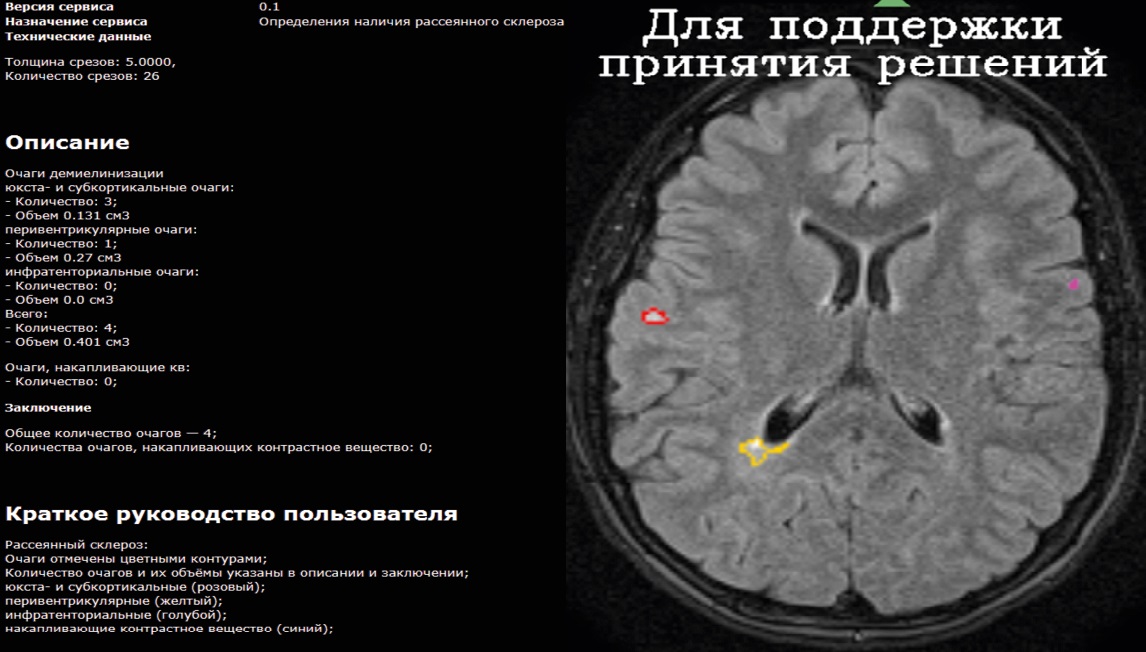
Рис. 4. Примеры работы ИИ-сервиса 1: девушка, 31 год, верифицированный диагноз – РС
Примечание: составлено авторами.
Очагов, накапливающих контрастное вещество, не выявлено, что может свидетельствовать об отсутствии активного воспалительного процесса на момент исследования.
Проблематика применения ИИ для диагностики и оценки динамики РС на данных МРТ изучается многими авторами. Результаты наиболее качественных исследований объединены в два метаанализа: Nabizadeh и соавт., 2023 и Daqqaq и соавт., 2024. В целом обе публикации приходят к сходным выводам. На ограниченных наборах данных, то есть в лабораторных условиях, достигаются высокие показатели диагностического качества. Так, объединенная точность составляет 0,88–0,97 и 0,985–0,991, чувствительность 0,90–0,95 и 0,984–0,991, специфичность 0,9–0,96 и 0,982–0,991 по результатам метаанализов 2023 и 2024 г. соответственно [22]. Примечательно, что показатели точности 2023 г. ниже. Это может быть объяснено разными подходами авторов к оценке качества, включаемых в обзор и метаанализ статей, а также некоторым прогрессом алгоритмов.
Статьи российских авторов в настоящее время носят более технический характер, включают описание процессов разработки алгоритмов и сравнения их архитектур.
Только в отдельных случаях публикуются результаты внешней валидации, проведенной, например, путем участия алгоритма в международных конкурсах [23]. Однако проверка ИИ в клинических условиях фактически не осуществляется.
Результаты, полученные нами, в целом соответствуют объединенным значениям чувствительности и специфичности, при этом тяготеют к верхним границам указанных диапазонов. Однако принципиальное отличие нашего исследования заключается в его проспективности. В отличие от сугубо лабораторных работ нами осуществлено тестирование ИИ-сервисов при их применении в условиях реальной клинической практики.
Ранее в нашем учреждении проводилось исследование точности ИИ для сортировки результатов МРТ в условиях городской поликлиники. Использованное техническое решение не участвовало в Московском Эксперименте. Однако проспективный характер исследования обуславливает его определенную ценность. На материале 93 пациентов в течение 1 месяца ИИ осуществлял «отсеивание» результатов исследований без признаков РС. Его чувствительность составила 100,0 %, специфичность – 75,3 %, AUROC – 0,861 [24].
Обращает на себя внимание дисбаланс чувствительности и специфичности, он обусловлен особым сценарием применения ИИ: сортировкой результатов МРТ. Ключевая задача для искусственного интеллекта здесь – не пропустить случай с РС. Отсюда возникает настройка на 100 % чувствительность, приводящую к генерации определенного процента ложноположительных ответов, но гарантированно отсутствуют пропуски патологии. В текущем исследовании рассматривается принципиально иной – морфометрический сценарий; в нем основной акцент сделан на дифференциацию очагов и их измерение. Соответственно и соотношение показателей точности требуется более сбалансированное.
Как было показано выше, в рамках Московского Эксперимента уже довольно длительное время применяются два ИИ-сервиса для диагностики рассеянного склероза и автоматизированной морфометрии очагов поражения. Это полностью независимые продукты, демонстрирующие разные показатели точности. С позиций дальнейшего их применения в практическом здравоохранении, вплоть до получения статуса медицинского изделия, необходимо большее внимание уделять именно клинической оценке. Площадь под характеристической кривой отражает точность бинарной оценки результатов МРТ конкретным ИИ-сервисом (то есть автоматического решения о наличии или отсутствии патологии); в то время как клиническая оценка представляет собой объективизацию точности локализации, сегментации, классификации и измерений очагов. В таком контексте ИИ-сервис № 2 показал больший потенциал.
В целом же можно констатировать, что технологии ИИ в диагностике рассеянного склероза применимы и могут достигать высокого уровня качества своей работы.
В заключение необходимо отметить наличие отдельного направления для автоматизированного анализа результатов МРТ, заключающегося в дифференциальной диагностике рассеянного склероза и заболеваний спектра оптиконевромиелита. Согласно метаанализу Etemadifar и соавт., 2024, на материале более 2,5 тысяч пациентов показана объединенная точность ИИ-сервисов для решения указанной задачи на уровне 78–86 %, чувствительности 79–88 %, специфичности 75–86 % [25]. Можно констатировать наличие очень серьезного потенциала для развития и этого направления. Очевидно, что поставленная нами морфометрическая задача для ИИ вовсе не является единственной. Тем не менее, учитывая влияние на оценку активности заболевания и эффективности терапии, полагаем именно ее основной.
ЗАКЛЮЧЕНИЕ
Анализ и описание врачом-рентгенологом результатов МРТ головного мозга в контексте оценки динамики и эффективности терапии рассеянного склероза сопряжено с высоким риском субъективности и большими временными затратами. Решением проблемы должно стать внедрение технологий автоматизированной морфометрии (выявления, классификации и измерения патологических очагов). Технологии искусственного интеллекта применимы для решения указанной задачи. В условиях практического здравоохранения качество их работы (медиана клинической оценки) достигает 94,0 %.
Список литературы
1. Rodríguez-Sánchez B., Daugbjerg S., Peña-Longobardo L. M. et al. Does the inclusion of societal costs change the economic evaluations recommendations? A systematic review for multiple sclerosis disease // The European Journal of Health Economics. 2023. Vol. 24. P. 247–277. https://doi.org/10.1007/s10198-022-01471-9.
2. Запарий С. П., Самусенко А. Г., Вязовиченко Ю. Е. и др. Тенденции формирования инвалидности вследствие рассеянного склероза в Москве в 2014-2021 годах // Эпидемиология и вакцинопрофилактика. 2023. Т. 22, № 1. С. 59–67. https://doi.org/10.31631/2073-3046-2023-22-1-59-67.
3. Мокрова А. С., Сологова С. С., Игнатьева В. И. Моделирование исходов и затрат при лечении рассеянного склероза // Фармацевтическое дело и технология лекарств. 2020. № 3. С. 11–34. https://doi.org/10.33920/med-13-2003-01.
4. Светличная А. В., Вязовиченко Ю. Е., Торчинский Н. В. и др. Изучение заболеваемости и частоты возможных факторов риска рассеянного склероза // Фундаментальная и клиническая медицина. 2021. Т. 6, № 4. С. 98–105. https://doi.org/10.23946/2500-0764-2021-6-4-98-105.
5. Бойнова И. В., Самарина Д. В., Каторова А. В. и др. Клинико-эпидемиологические особенности рассеянного склероза в Российской Федерации // Современные проблемы науки и образования. 2022. № 5. С. 139–150. https://doi.org/10.17513 // spno.32006.
6. Суминов В. В., Анциферова Е. В. Сравнение распространенности рассеянного склероза в Российской Федерации и за ее пределами // Молодежный инновационный вестник. 2022. Т. 11, № S1. С. 314–317.
7. Dobson R., Rice D. R., D’hooghe M. et al. Social determinants of health in multiple sclerosis // Nature Reviews Neurology. 2022. Vol. 18. P. 723–734. https://doi.org/10.1038/s41582-022-00735-5.
8. Lorefice L., Lugaresi A. Women and multiple sclerosis: From gender medicine to precision medicine // Multiple Sclerosis and Related Disorders. 2025. Vol. 96. https://doi.org/10.1016/j.msard.2025.106348.
9. Васильев Ю. А., Владзимирский А. В., Омелянская О. В. и др. Обзор метаанализов о применении искусственного интеллекта в лучевой диагностике // Медицинская визуализация. 2024. Т. 28, № 3. С. 22–41. https://doi.org/10.24835/1607-0763-1425.
10. Шамилина Е. А., Конева Е. С., Сазонова Е. О. и др. Рассеянный склероз: современное состояние проблемы (обзорная статья) // Физиотерапевт. 2024. № 6. С. 121–127.
11. Rodríguez Murúa S., Farez M. F., Quintana F. J. The immune response in multiple sclerosis // Annual Review of Pathology: Mechanisms of Disease. 2022. Vol. 17. P. 121–139. https://doi.org/10.1146/annurev-pathol-052920-040318.
12. Владзимирский А. В., Шулькин И. М., Омелянская О. В. и др. MosMedData: MPT с признаками рассеянного склероза: свидетельство о государственной регистрации базы данных, охраняемой авторскими правами 2023621236 Рос. Федерация. № 2023620627; заявл. 10.03.2023; опубл. 18.04.2023. URL: https://www.elibrary.ru/download/elibrary_52124202_70088021.PDF (дата обращения: 07.04.2025).
13. Ward M., Goldman M. D. Epidemiology and pathophysiology of multiple sclerosis // Continuum. 2022. Vol. 28, no. 4. P. 988–1005. https://doi.org/10.1212/CON.0000000000001136.
14. Турчинская И. А., Шериев С. Р., Ефимцев А. Ю. и др. Специальные методики МРТ в диагностике рассеянного склероза // Российский журнал персонализированной медицины. 2024. Т. 4, № 1. С. 12–18. https://doi.org/10.18705/2782-3806-2024-4-1-12-18.
15. Васильев Ю. А., Владзимирский А. В., Омелянская О. В. и др. Методология тестирования и мониторинга программного обеспечения на основе технологий искусственного интеллекта для медицинской диагностики // Digital Diagnostics. 2023. Т. 4, № 3. С. 252–267. https://doi.org/10.17816/DD321971.
16. Filippi M., Rocca M. A., Ciccarelli O. et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines // The Lancet Neurology. 2016. Vol. 15, no. 3. P. 292–303.
17. Naval-Baudin P., Pérez-Alfonso K., Castillo-Pinar A. et al. Post-contrast susceptibility weighted imaging in multiple sclerosis MRI improves the detection of enhancing lesions // Clinical Neuroradiology. 2025. https://doi.org/10.1007/s00062-025-01508-5.
18. Nguyen P., Rempe T., Forghani R. Multiple sclerosis: Clinical update and clinically-oriented radiologic reporting // Magnetic Resonance Imaging Clinics of North America. 2024. Vol. 32, no. 2. P. 363–374. https://doi.org/10.1016/j.mric.2024.01.001.
19. Тыров И. А., Васильев Ю. А., Арзамасов К. М. и др. Оценка зрелости технологий искусственного интеллекта для здравоохранения: методология и ее применение на материалах московского эксперимента по компьютерному зрению в лучевой диагностике // Врач и информационные технологии. 2022. № 4. С. 76–92. https://doi.org/10.25881/18110193_2022_4_76.
20. Hanley J. A., McNeil B. J. The meaning and use of the area under a receiver operating characteristic (ROC) curve // Radiology. 1982. Vol. 143, no. 1. P. 29–36. https://doi.org/10.1148/radiology.143.1.7063747.
21. Киселева Е. В., Спирин Н. В. Клинические и МРТ особенности злокачественного рассеянного склероза // Российский нейрохирургический журнал имени профессора А. Л. Поленова. 2021. Т. 13, № 2. С. 39–42.
22. Коптева Ю. П., Агафьина А. С., Труфанов Г. Е. и др. Магнитно-резонансная томография коннектома в оценке результатов нейрореабилитации у пациентов с рассеянным склерозом // Российский журнал персонализированной медицины. 2023. Т. 3, № 1. С. 43–53. https://doi.org/10.18705/2782-3806-2023-3-1-43-53.
23. Federau C., Hainc N., Edjlali M. et al. Evaluation of the quality and the productivity of neuroradiological reading of multiple sclerosis follow-up MRI scans using an intelligent automation software // Neuroradiology. 2024. Vol. 66. P. 361–369. https://doi.org/10.1007/s00234-024-03293-3.
24. Lee J. K., Bermel R., Bullen J. et al. Structured reporting in multiple sclerosis reduces interpretation time // Academic Radiology. 2021. Vol. 28, no. 12. P. 1733–1738. https://doi.org/10.1016/j.acra.2020.08.006.
25. Mendelsohn Z., Pemberton H. G., Gray J. et al. Commercial volumetric MRI reporting tools in multiple sclerosis: A systematic review of the evidence // Neuroradiology. 2023. Vol. 65. P. 5–24. https://doi.org/10.1007/s00234-022-03074-w.
Об авторах
Н. Д. АдамияРоссия
врач-рентгенолог, аспирант
А. В. Владзимирский
Россия
доктор медицинских наук, заместитель директора по научной работе
Рецензия
Для цитирования:
Адамия Н.Д., Владзимирский А.В. ПРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ КАЧЕСТВА ТЕХНОЛОГИЙ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА ПРИ АНАЛИЗЕ РЕЗУЛЬТАТОВ МАГНИТНО‑РЕЗОНАНСНОЙ ТОМОГРАФИИ ДЛЯ ВЫЯВЛЕНИЯ И ОЦЕНКИ ОЧАГОВ ДЕМИЕЛИНИЗАЦИИ. Вестник СурГУ. Медицина. 2025;18(3):29-38. https://doi.org/10.35266/2949-3447-2025-3-4
For citation:
Adamiia N.D., Vladzymyrskyy A.V. PROSPECTIVE STUDY ON ARTIFICIAL INTELLIGENCE TECHNOLOGIES QUALITY IN MAGNETIC RESONANCE IMAGING RESULTS ANALYSIS FOR DETECTION AND ASSESSMENT OF DEMYELINATION LESIONS. Vestnik SurGU. Meditsina. 2025;18(3):29-38. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-4




















