Перейти к:
КРАТКОСРОЧНЫЕ МАРКЕРЫ ГЛИКЕМИЧЕСКОГО КОНТРОЛЯ ПРИ ГЕСТАЦИОННОМ САХАРНОМ ДИАБЕТЕ
https://doi.org/10.35266/2949-3447-2025-2-6
Аннотация
Проведено изучение диагностической и прогностической значимости определения уровня фруктозамина и 1,5‑ангидидроглюцитола в периферической крови во время беременности, осложненной гестационным сахарным диабетом. Нами получены результаты, указывающие на отсутствие различий в уровнях этих маркеров, при сравнении с гликированным гемоглобином и глюкозой плазмы натощак, в зависимости от наличия железодефицитной анемии легкой степени. Более высокие показатели фруктозамина в третьем триместре были ассоциированы с макросомией плода.
Ключевые слова
Для цитирования:
Белоцерковцева Л.Д., Ерченко Е.Н., Мордовина И.И., Васильева Т.В. КРАТКОСРОЧНЫЕ МАРКЕРЫ ГЛИКЕМИЧЕСКОГО КОНТРОЛЯ ПРИ ГЕСТАЦИОННОМ САХАРНОМ ДИАБЕТЕ. Вестник СурГУ. Медицина. 2025;18(2):45-51. https://doi.org/10.35266/2949-3447-2025-2-6
For citation:
Belotserkovtseva L.D., Erchenko E.N., Mordovina I.I., Vasilyeva T.V. SHORT-TERM MARKERS OF GLYCEMIC CONTROL IN GESTATIONAL DIABETES MELLITUS. Vestnik SurGU. Meditsina. 2025;18(2):45-51. (In Russ.) https://doi.org/10.35266/2949-3447-2025-2-6
ВВЕДЕНИЕ
Гестационный сахарный диабет (ГСД) остается актуальной проблемой современного акушерства в связи с высоким риском материнских и перинатальных осложнений. За последние десятилетия его частота возросла, главным образом из-за увеличения распространенности ожирения и отсроченного деторождения [1][2]. По данным Бюджетного учреждения Ханты-Мансийского автономного округа – Югры «Сургутский окружной клинический центр охраны материнства и детства», частота родов с ГСД за последние 5 лет составляет в среднем 17 %, без тенденции к снижению.
Своевременная диагностика и лечение данного состояния имеет важное медицинское и социальное значение, как в профилактике осложнений со стороны плода, включая формирование макросомии плода и диабетической фетопатии, респираторный дистресс-синдром, нарушение обмена веществ, асфиксию и другие неонатальные осложнения; так и эпигенетических аспектов нарушений метаболических процессов организма матери и ребенка [3]. Строгий контроль за уровнем глюкозы во время беременности, осложненной ГСД, снижает вероятность рождения крупного плода. Для женщин с ГСД уровень HbA1c < 6 % (42 ммоль/моль) необходим для предотвращения макросомии. Однако недавние исследования по-прежнему сообщают о высоких показателях макросомии, которые составляют около 15 % при ГСД [4] и до 50 % при сахарном диабете 1 типа (СД1) [5]. Такие высокие показатели могут быть результатом механизмов, не связанных с глюкозой, таких как дислипидемия у беременных женщин с ожирением или избыточный вес во время беременности [6]. Тем не менее, даже умеренно высокие уровни глюкозы могут способствовать избыточному росту плода при «хорошо контролируемом» диабете, если они возникают на ранних сроках беременности или находятся в пределах более высокого диапазона рекомендуемых уровней глюкозы.
С целью метаболического контроля во время беременности, осложненной ГСД, традиционно используется метод самоконтроля уровня глюкозы с помощью портативных приборов (глюкометров), калиброванных по плазме, а также определение гликированного гемоглобина (HbA1c) [1][2]. Каждый из этих методов имеет свои ограничения и недостатки. Самоконтроль глюкометром позволяет определить только текущий уровень глюкозы крови, в момент измерения, не отражая вариабельности гликемии, требуя частых измерений. При этом, неудобство самостоятельного сбора крови часто приводит к нарушению соблюдения правил и плохому комплаенсу. HbA1c показывает средний уровень глюкозы крови за предыдущие 2–3 месяца, недостатки данного маркера включают ограниченную интерпретируемость с учетом индивидуальной вариабельности гликемии, на него влияют железодефицитные состояния, часто определяемые у беременных. Так, у пациентов с железодефицитной анемией (ЖДА) HbA1c повышен и его уровни также повышаются при дефиците железа без анемии [7]. Также следует учитывать укорочение периода полужизни эритроцитов вследствие активизации эритропоэза в период гестации, что не позволяет рассматривать данный показатель как надежный во время беременности, осложненной сахарным диабетом. Поэтому HbA1c неточно отражает колебания гликемии у беременных с ГСД.
Такие краткосрочные гликемические маркеры, как как фруктозамин (ФА) или 1,5-ангидроглюцитол (1,5-AГ) могут представлять практический и научный интерес при ведении беременности с ГСД.
ФА является индикатором среднего уровня глюкозы за последние 2–3 недели. Ценностью метода является то, что на уровень ФА не влияют характеристики гемоглобина. Метод измерения ФА является недорогим, быстрым, технически простым, но его диагностические и целевые значения во время беременности на сегодняшний день не разработаны [7–9]. Известны несколько исследований, посвященных поиску зависимости между уровнем ФА и состоянием плода. Проспективное когортное исследование 41 беременной женщины с гестационным и предгестационным диабетом, проведенное M. R. Delgado и соавт. (2011) для оценки корреляции между метаболическим контролем и наличием или отсутствием макросомии, не выявило никакой связи между макросомией и уровнями ФА [9]. В другом проспективном когортном исследовании N. Mendes с соавт. (2019) изучали взаимосвязь между HbA1c, гликированным альбумином и ФА с массой тела новорожденного при рождении у 82 беременных с ГСД. Было показано, что гликированный альбумин и ФА имеют более значимую корреляцию с макросомией плода, чем HbA1c [10]. P. Poupon с соавт. (2020) определяли сывороточные уровни ФА и HbA1c на 25 ± 7 неделе беременности у 130 женщин с гипергликемией при одноплодной беременности (117 с ГСД, 13 с прегестационным диабетом): высокий уровень ФА был связан с макросомией у новорожденных беременных женщин с хорошо контролируемой гипергликемией. Уровень ФА был выше при макросомии плода: 221 ± 40 мкмоль/л против 192 ± 22 мкмоль/л (р < 0,001) соответственно и оставался значимым даже после корректировки на возраст матери, индекс массы тела, количество родов, тип диабета, предшествующие макросомии и чрезмерное увеличение веса во время беременности. Напротив, уровень HbA1c не отличался между двумя группами [11].
Другой краткосрочный маркер – 1,5-АГ – отражает колебания гликемии в течение 1–2 недель. При ГСД уровень 1,5-АГ может быть более низким, чем у беременных без сахарного диабета, за счет конкурентного ингибирования его реабсорбции глюкозой. Низкий уровень 1,5-АГ у беременных женщин с сахарным диабетом 1 типа и ГСД может являться предиктором макросомии плода, но диагностическая чувствительность и специфичность метода не высокие, по данным исследований [12][13]. N. Nowak и соавт. (2013) показали, что у беременных женщин с диабетом 1 типа 1,5-AG является лучшим гликемическим маркером, чем HbA1c. Снижение уровня 1,5-AG в третьем триместре, как отдельно, так и с HbA1c, является сильным предиктором макросомии [14]. S. S. Delaney и соавт. (2015) провели ретроспективное когортное исследование, включающее 85 беременностей, осложненных диабетом (37–1 типа, 24–2 типа, 24 – ГСД). У пациентов с диабетом 1 типа был самый низкий средний уровень 1,5-ангидроглюцитола 3,5 мкг/мл (SD = 1,6 мкг/мл) и самый высокий средний уровень HbA1c 6,5 % (SD = 0,74 %) по сравнению с пациентами с ГСД, у которых был самый высокий средний уровень 1,5-ангидроглюцитола 6,7 мкг/мл (SD = 3,8 мкг/мл) и самый низкий средний уровень HbA1c 6,0 % (SD = 0,94 %). При беременности, осложненной диабетом, низкий уровень 1,5-ангидроглюцитола был связан с увеличением веса новорожденного [15].
Цель – изучить диагностическую и прогностическую значимость использования краткосрочных маркеров гликемического контроля – фруктозамина и 1,5-ангидидроглюцитола – при гестационном сахарном диабете в зависимости от наличия железодефицитной анемии и макросомии плода.
МАТЕРИАЛЫ И МЕТОДЫ
Мы проводили наблюдение и обследование 69 беременных женщин с ГСД, которые состояли на учете в Консультативно-диагностическом отделении Сургутского окружного клинического центра охраны материнства и детства в 2024 г. Диагноз ГСД был выставлен на основании утвержденных критериев [1][2]. У 37 (53,6 %) пациенток ГСД был выявлен в I триместре беременности, у остальных 32 (46,4 %) – после 24 недель. Только диетотерапия проводилась у 52 (75,4 %), инсулинотерапия потребовалась 17 (24,6 %) пациенткам.
Протокол исследования одобрен локальным этическим комитетом учреждения, все пациентки подписали информированное добровольное согласие для участия в исследовании. Критерии исключения из исследования: многоплодная беременность, прегестационный сахарный диабет, ВИЧ-инфекция, возраст до 18 лет. Пациентки были разделены на группы в зависимости от наличия ЖДА, а также с учетом веса новорожденного.
На первом этапе мы выделили две группы: первая – беременные с ЖДА (n = 24), и вторая группа – беременные без ЖДА (n = 45). Диагноз ЖДА выставлялся в соответствии с критериями диагностики во время беременности на основании показателей общего клинического анализа крови и сывороточного ферритина [16].
На втором этапе анализ проводился в зависимости от исходов родов: первую группу составили беременные, у которых произошли роды плодом, крупным для гестационного срока (n = 19), вторую группу – беременные, которые родоразрешились плодом с нормальным весом (n = 50). Вес и рост плода оценивали по перцентильным таблицам (шкала Intergrowth-21st), макросомию устанавливали с учетом срока родоразрешения при значениях веса новорожденного в диапазоне 90 и более перцентилей.
Проводилась оценка течения беременности, родов и результатов обследования: глюкозы плазмы натощак, HbA1c крови, ФА и 1,5-АГ. Глюкозу плазмы крови определяли гексокиназным методом. Определение HbA1c, ФА и 1,5-АГ проводили в сроке 28–32 недель беременности, после установления диагноза ГСД. Уровень HbA1c определяли методом турбидиметрического иммуноингибирования. Нормальный уровень HbA1c во время беременности – до 6,5 %. Определение ФА проводили кинетическим колориметрическим методом на автоматическом биохимическом анализаторе AU 5800, Beckman Coulter, США. Нормальные показатели ФА в сыворотке и плазме – 100–285 мкмоль/л. Референсные значения ФА во время беременности не разработаны. Определение 1,5-AG проводили методом конкурентного иммуноферментного анализа на иммунохимическом анализаторе Evolis BioRad, США. Референсное значение 1,5-АГ для женщин (по данным литературы) – 6,8–29,3 мкг/мл, во время беременности при сроке до 23 недель – 9,2–49 мкг/мл, 6,1–27,2 мкг/мл – на сроке 24–28 недель, 5,6–25,4 мкг/мл – на сроке 29–32 недели и 5,4–40,4 мкг/мл – на сроке > 32 недель [12][17].
Статистический анализ проводился с использованием программы StatTech v. 4.5.0. Данные представлены в виде средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ) в случае нормального распределения, при этом сравнение двух групп проводилось с использованием t-критерия Стьюдента. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1 – Q3), их сравнение проводилось с помощью U-критерия Манна-Уитни. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение процентных долей выполнялось с помощью критерия хи-квадрат Пирсона и точного критерия Фишера. Результаты считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Возраст пациенток с ГСД находился в диапазоне от 19 до 43 лет, средний возраст составил 33,3 ± 5,3 г (M ± SD). На первом этапе анализ проводили с учетом наличия ЖДА. Первую группу составили 24 беременных с ГСД и ЖДА легкой степени, вторую группу – 45 беременных с ГСД и нормальным уровнем гемоглобина в течение всей беременности. У всех обследуемых первой группы зарегистрирована ЖДА легкой степени, случаев ЖДА средней и тяжелой степени не было. Группы были сопоставимы по паритету, индексу массы тела, срокам диагностики и лечению ГСД, не отличались по срокам и методам родоразрешения и частоте рождения крупных детей. Обращает на себя внимание, что в группе с ЖДА беременные были в среднем на 4 года моложе, разница статистически значимая (табл. 1).
При сравнении показателей глюкозы натощак, HbA1c, ФА и 1,5-АГ, определяемых у беременных в группах с учетом наличия ЖДА легкой степени, не удалось установить статистически значимых различий (табл. 2).
На втором этапе мы анализировали показатели гликемического контроля с учетом веса новорожденного. Первую группу составили 19 беременных с рождением плода, крупного для гестационного срока, вторую группу – 50 беременных с рождением плода без признаков макросомии. Группы были сопоставимы по возрасту, индексу массы тела, срокам выявления и лечению ГСД. В первой группе преобладали повторнородящие (89,5 %, n = 17), по сравнению со второй группой (66 %, n = 33), различия статистически значимые (p = 0,04).
При сравнении показателей глюкозы натощак, HbA1c и 1,5-АГ, определяемых у беременных в группах с учетом макросомии плода, не удалось установить статистически значимых различий (табл. 3). Показатели ФА в группе с рождением плода массой более 90 перцентилей для гестационного срока, были выше, чем в группе с рождением ребенка с нормальным весом, различия статистически значимы (р = 0,017), данные представлены в табл. 3 и на рисунке. Фактически каждая вторая беременная (9 женщин – 47 %), у которой произошло рождение плода, крупного для гестационного срока, имела уровень ФА 182 мкмоль/л и выше, против 9 (18 %) матерей новорожденных без макросомии (р < 0,05).
Таким образом, уровень сывороточного ФА может рассматриваться как потенциальный маркер формирования макросомии плода, что подтверждает результаты ранее проведенных исследований других авторов [10][11]. ЖДА легкой степени тяжести, вероятно, не оказывает существенного влияния на различия показателей традиционных и краткосрочных гликемических маркеров при ГСД; возможно, при ЖДА средней и тяжелой степени результаты будут иными.
Таблица 1
Характеристика групп с учетом наличия ЖДА
Категории | I группа (ГСД и ЖДА), n = 24 | II группа (ГСД без ЖДА), n = 45 | p |
Возраст, лет, M ± SD (95 % ДИ) | 30,58 ± 5,83 (28,12–33,05) | 34,82 ± 4,47 (33,48–36,17) | 0,001* |
Повторнородящие, n (%) | 18 (75) | 32 (71,1) | 0,731 |
Индекс массы тела, кг/м 2, Me (Q₁ – Q₃) | 28,6 (24,8–32,0) | 28,4 (24,7–33,9) | 0,835 |
Ожирение (ИМТ 30 кг/м 2 и более), n (%) | 11 (45,8) | 18 (40,0) | 0,64 |
Отягощенная наследственность по СД, n (%) | 3 (12,5) | 4 (8,9) | 0,687 |
Крупный плод в анамнезе, n (%) | 7 (29,2) | 7 (15,6) | 0,217 |
ГСД в анамнезе, n (%) | 4 (16,7) | 2 (4,4) | 0,173 |
Ранее выявление ГСД (в первом триместре), n (%) | 15 (62,5) | 22 (48,9) | 0,28 |
Лечение ГСД – инсулинотерапия, n (%) | 5 (20,8) | 12 (26,7) | 0,592 |
Преэклампсия, n (%) | 2 (8,3) | 1 (2,2) | 0,276 |
Многоводие, n (%) | 3 (12,5) | 2 (4,4) | 0,333 |
Маловодие, n (%) | 0 (0) | 2 (4,4) | 0,54 |
Срочные роды, n (%) | 24 (100) | 41 (95,3) | 0,533 |
Кесарево сечение, n (%) | 8 (33,3) | 15 (34,9) | 0,898 |
Вакуум-экстракция плода, n (%) | 0 (0) | 1 (2,3) | 1,0 |
Макросомия плода (90 и более перцентилей), n (%) | 9 (37,5) | 10 (23,3) | 0,215 |
Вес новорожденного, г, Me (Q₁ – Q₃) | 3575 (3330–3895) | 3500 (3285–3905) | 0,7 |
Примечание: * – р < 0,05. Составлено авторами.
Таблица 2
Показатели гликемического контроля при ГСД с учетом наличия ЖДА, Me (Q₁ – Q₃)
Показатели | I группа (ГСД и ЖДА), n = 24 | II группа (ГСД без ЖДА), | p |
Глюкоза натощак, ммоль/л | 5,25 (5,2–5,33) | 5,2 (5,1–5,5) | 0,863 |
Гликированный гемоглобин, % | 5,24 (4,75–5,6) | 5,16 (4,84–5,47) | 0,61 |
ФА, мкмоль/л | 165 (151,5–181,25) | 159 (146–182) | 0,845 |
1,5-ангидроглюцитол, мкг/мл | 2,6 (1,65–3,62) | 2,7 (2,0–3,4) | 0,512 |
Примечание: составлено авторами.
Таблица 3
Показатели гликемического контроля при ГСД с учетом макросомии плода
Показатели | I группа (ГСД и макросомия плода), n = 19 | II группа (ГСД без макросомии плода), n = 50 | p |
Глюкоза натощак, ммоль/л, Me (Q₁ – Q₃) | 5,2 (5,2–5,5) | 5,2 (5,17–5,4) | 0,563 |
Гликированный гемоглобин, %, Me (Q₁ – Q₃) | 5,37 (5,05–5,65) | 5,12 (4,79–5,42) | 0,072 |
ФА, мкмоль/л, M ± SD (95 % ДИ) | 175,84 ± 20,11 (166,15–185,54) | 158,81 ± 27,59 (150,80–166,82) | 0,017* |
1,5-ангидроглюцитол, мкг/мл, Me (Q₁ – Q₃) | 2,2 (2,0–3,35) | 2,9 (1,9–3,4) | 0,419 |
Примечание: * – р < 0,05. Составлено авторами.
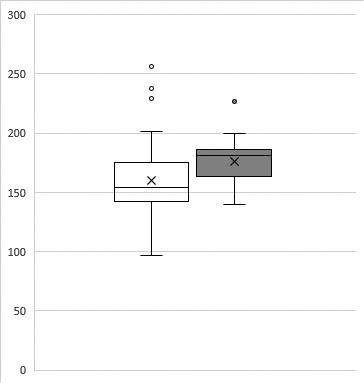
Рисунок. Показатели ФА (мкмоль/л) во время беременности при рождении ребенка с нормальным весом (слева, светлый фон) и с признаками макросомии (справа, темный фон)
Примечание: составлено авторами.
ЗАКЛЮЧЕНИЕ
Ведение беременных с ГСД требует поиска доступных и информативных маркеров гликемического контроля в качестве предикторов акушерских и перинатальных осложнений, что представляет интерес для практического здравоохранения. Наше исследование не выявило преимуществ определения таких краткосрочных маркеров, как ФА и 1,5-ангидроглюцитол, по сравнению с традиционными показателями гликемического контроля при наличии ЖДА легкой степени у беременных с ГСД. При этом более высокие показатели ФА в третьем триместре были ассоциированы с формированием макросомии плода. Уточнение значимости и прогностической ценности краткосрочных маркеров гликемии при ГСД требует дальнейших исследований.
Список литературы
1. Гестационный сахарный диабет : клинические рекомендации. 2024. URL: https://cr.minzdrav.gov.ru/view-cr/841_1 (дата обращения: 01.01.2025).
2. Алгоритмы специализированной медицинской помощи больным сахарным диабетом : клинические рекомендации. 11-й выпуск / под ред. И. И. Дедов, М. В. Шестакова, А. Ю. Майоров. М. : Российская ассоциация эндокринологов, 2023. 157 с.
3. Белоцерковцева Л. Д., Конченкова Е. Н., Киличева И. И. и др. Ведение беременности при гестационном сахарном диабете // Вопросы гинекологии, акушерства и перинатологии. 2020. Т. 19, № 3. С. 40–44.
4. Billionnet C., Mitanchez D., Weill A. et al. Gestational diabetes and adverse perinatal outcomes from 716,152 births in France in 2012 // Diabetologia. 2017. Vol. 60. P. 636–644. https://doi.org/10.1007/s00125-017-4206-6.
5. Ladfors L., Shaat N., Wiberg N. et al. Fetal overgrowth in women with type 1 and type 2 diabetes mellitus // PLoS One. 2017. Vol. 12, no. 11. P. e0187917. https://doi.org/10.1371/journal. pone.0187917.
6. Santos M. J., Fernandes V., Marques O. et al. Effect of maternal body mass index and weight gain in women with gestational diabetes on the incidence of large-for-gestationalage infants // Diabetes & Metabolism. 2016. Vol. 42, no. 6. Р. 471–474. https://doi.org/10.1016/j.diabet.2016.06.008.
7. Mendes N., Ribeiro R. T., Serrano F. Beyond self-monitored plasma glucose and HbA1c: the role of non-traditional glycaemic markers in gestational diabetes mellitus // Journal of Obstetrics and Gynaecology. 2018. Vol. 38, no. 6. P. 762–769. https://doi.org/10.1080/01443615.2017.1412409.
8. Ribeiro R. T., Macedo M. P., Raposo J. F. HbA1c, fructosamine, and glycated albumin in the detection of dysglycaemic conditions // Current Diabetes Reviews. 2016. Vol. 12, no. 1. P. 14–19. https://doi.org/10.2174/1573399811666150701143112.
9. Delgado M. R., Novik A. V., Cardemil M. F. et al. Plasma fructosamine to evaluate metabolic control among women with gestational diabetes // Revista Médica de Chile. 2011. Vol. 139, no. 11. Р. 1444–1450.
10. Mendes N., Alves M., Andrade R. et al. Association between glycated haemoglobin, glycated albumin and fructosamine with neonatal birthweight and large-for-date status infants in gestational diabetes mellitus: A prospective cohort study // Journal of Obstetrics and Gynaecology. 2019. Vol. 39, no. 6. P. 768–773. https://doi.org/10.1080/01443615.2019.1584886.
11. Poupon P., Foussard N., Helmer C. et al. Serum fructosamine predicts macrosomia in well-controlled hyperglycaemic pregnant women: An observational cross-sectional study // Diabetes & Metabolism. 2020. Vol. 46, no. 3. P. 219–222. https://doi.org/10.1016/j.diabet.2019.07.003.
12. Климонтов В. В., Дашкин М. В. 1,5-ангидроглюцитол при сахарном диабете: роль в диагностике, скрининге, оценке гликемического статуса и прогнозе осложнений // Сахарный диабет. 2020. Т. 23, № 3. С. 250–259. https://doi.org/10.14341/DM10258.
13. Арбузова М. И., Ильин А. В. Перспективен ли тест 1,5-ангидро-D-глюцитол для контроля компенсации и лечения сахарного диабета? // Сахарный диабет. 2010. Т. 13, № 1. С. 123–125. https:// doi.org/10.14341/2072-0351-6027.
14. Nowak N., Skupien J., Cyganek K. et al. 1,5-Anhydroglucitol as a marker of maternal glycaemic control and predictor of neonatal birthweight in pregnancies complicated by type 1 diabetes mellitus // Diabetologia. 2013. Vol. 56, no. 4. P. 709–713. https://doi.org/10.1007/s00125-013-2830-3.
15. Delaney S. S., Coley L. Y., Brown Z. 1,5-Angydroglucitol: A new predictor of birth weight in diabetic pregnancies // European Journal of Obstetrics & Gynecology and Reprouctive Biology. 2015. Vol. 189. P. 55–58. https://doi.org/10.1016/j.ejogrb.2015.03.021.
16. Нормальная беременность : клинические рекомендации. 2023. URL: https://5-point.ru/wp-content/uploads/Normal_beremennosty_2023.pdf (дата обращения: 01.01.2025).
17. Welter M., Boritza K. C., Anghebem-Oliveira M. I. et al. Reference intervals for serum 1,5-anhydroglucitol in children, adolescents, adults and pregnant women // Clinica Chimica Acta. 2018. Vol. 486. P. 54–58. https://doi.org/10.1016/j.cca.2018.07.018.
Об авторах
Л. Д. БелоцерковцеваРоссия
доктор медицинских наук, профессор, заслуженный врач РФ, заведующая кафедрой акушерства, гинекологии и перинатологии, президент
Е. Н. Ерченко
Россия
кандидат медицинских наук, доцент
И. И. Мордовина
Россия
кандидат медицинских наук, доцент
Т. В. Васильева
Россия
заведующая клинико-диагностической лабораторией
Рецензия
Для цитирования:
Белоцерковцева Л.Д., Ерченко Е.Н., Мордовина И.И., Васильева Т.В. КРАТКОСРОЧНЫЕ МАРКЕРЫ ГЛИКЕМИЧЕСКОГО КОНТРОЛЯ ПРИ ГЕСТАЦИОННОМ САХАРНОМ ДИАБЕТЕ. Вестник СурГУ. Медицина. 2025;18(2):45-51. https://doi.org/10.35266/2949-3447-2025-2-6
For citation:
Belotserkovtseva L.D., Erchenko E.N., Mordovina I.I., Vasilyeva T.V. SHORT-TERM MARKERS OF GLYCEMIC CONTROL IN GESTATIONAL DIABETES MELLITUS. Vestnik SurGU. Meditsina. 2025;18(2):45-51. (In Russ.) https://doi.org/10.35266/2949-3447-2025-2-6
JATS XML




















