Перейти к:
СНИЖЕНИЕ ГЕПАТОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ С ПРИМЕНЕНИЕМ ИММОБИЛИЗИРОВАННОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА
https://doi.org/10.35266/2949-3447-2025-3-11
Аннотация
Цель – исследование возможности снижения токсического действия препаратов, используемых в онкологической практике, на печень экспериментальных животных. Для коррекции обнаруженных в эксперименте гепатотоксических эффектов противоопухолевых препаратов фарморубицина и цисплатина крысам вводили иммобилизированный гранулоцитарный колониестимулирующий фактор человека (имГ-КСФ). Препарат имГ-КСФ был получен путем конъюгации молекул негликозилированного цитокина с полиэтиленгликолем молекулярной массой 1500 Да. ИмГ-КСФ и препарат сравнения филграстим (Нейпоген) вводили крысам подкожно в дозе 100 мкг/кг курсом 5 дней, начиная со второго дня после однократного введения цитостатиков. Получены данные о положительном влиянии имГ-КСФ на уровень ферментов печени экспериментальных животных после цитостатического воздействия. Были отмечены нормализация показателей активности печеночных ферментов в сыворотке крови и снижение интенсивности воспалительных процессов в паренхиме печени крыс, вызванных введением цитостатиков, а также стимуляция регенераторных процессов. Таким образом, показано, что применение имГ-КСФ после введения цисплатина и фарморубицина снижает выраженность токсического и повреждающего действия цитостатиков на печень экспериментальных животных.
Для цитирования:
Дубская Т.Ю., Ветошкина Т.В., Сандрикина Л.А., Фомина Т.И., Федорова Е.П., Мадонов П.Г., Чурин А.А. СНИЖЕНИЕ ГЕПАТОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ С ПРИМЕНЕНИЕМ ИММОБИЛИЗИРОВАННОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА. Вестник СурГУ. Медицина. 2025;18(3):85-91. https://doi.org/10.35266/2949-3447-2025-3-11
For citation:
Dubskaya T.Yu., Vetoshkina T.V., Sandrikina L.A., Fomina T.I., Fedorova E.P., Madonov P.G., Churin A.A. CORRECTION OF ANTINEOPLASTIC DRUGS INDUCED HEPATOTOXICITY USING IMMOBILIZED GRANULOCYTE-COLONY STIMULATING FACTOR. Vestnik SurGU. Meditsina. 2025;18(3):85-91. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-11
ВВЕДЕНИЕ
Противоопухолевая химиотерапия, как правило, сопровождается токсическими явлениями, порой угрожающими жизни больного [1–3]. В связи с этим особую актуальность приобретает задача снижения токсичности лекарственных препаратов, обладающих антибластомной активностью, уменьшения их повреждающего влияния на здоровые ткани организма и, в частности, на печень [4][5]. В настоящее время в клинической практике широко применяются препараты на основе рекомбинантных форм гемопоэтических ростовых факторов, способных активировать регенераторные возможности организма для восстановления поврежденных тканей [6][7]. Гранулоцитарный колониестимулирующий фактор человека (Г-КСФ) используется в онкологии и при лечении ряда инфекционных заболеваний, а также для активизации процессов выхода стволовых клеток из костного мозга. Введение препарата Г-КСФ, мобилизующего мезенхимальные стволовые клетки, способствует реализации их регенераторного потенциала [8][9]. До последнего времени на российском рынке присутствовали только дорогостоящие импортные препараты Г-КСФ. Наиболее известны ленограстим (Граноцит) и филграстим (Нейпоген), разрешенные для использования в онкологической практике [9]. Сейчас созданы отечественные препараты, в частности иммобилизированный ГКСФ, по своей активности не уступающий зарубежным аналогам.
В настоящей работе изучалась возможность коррекции побочного действия противоопухолевых препаратов на печень экспериментальных животных. При введении цитостатиков цисплатина и фарморубицина в максимально переносимой дозе (МПД) наблюдались отклонения лабораторных показателей от нормального уровня. Нами изучена возможность снижения токсического действия противоопухолевых препаратов на печень крыс с использованием препарата имГ-КСФ, который проявлял в эксперименте гепатопротективную активность [10–12]. В качестве референсного агента применяли нейпоген, препарат негликолизированного Г-КСФ человека (филграстим) (Швейцария).
Цель – исследование возможности снижения токсического действия препаратов, используемых в онкологической практике, на печень экспериментальных животных.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 100 белых аутбредных крысах-самках в возрасте 2,5 месяца массой 150–250 г. [13]. Содержание животных согласовано с правилами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). Для создания модели токсического поражения печени антибластомными препаратами в ходе химиотерапевтического лечения были использованы: цисплатин (Сisplatin-Teva, «ТЕВА Фармацевтические предприятия Лтд», Израиль), препарат, содержащий платину и препарат растительного происхождения; фарморубицин (Epirubicin, «Пфайзер Италия С. р.л.», Италия), противоопухолевый антибиотик. Для коррекции выявленных нарушений применен имГ-КСФ, препарат отечественного производства, произведенный ООО «Саентифик фьючер менеджмент» (г. Новосибирск, Россия) путем конъюгации молекул негликозилированного цитокина с полиэтиленгликолем молекулярной массы 1 500 Да с помощью электронно-лучевого синтеза. В качестве препарата сравнения применен нейпоген (Neupogen vial, Filgrastim, «Ф. Хоффманн – Ля Рош Лтд», Швейцария), представляющий собой форму рекомбинантной ДНК природного гранулоцитарного колониестимулирующего фактора. Цитостатики цисплатин и фарморубицин вводили однократно внутривенно. МПД для цисплатина и фарморубицина рассчитывали методом графического пробит-анализа [14], МПД (доза, вызывающая 5 % летальность) составила для цисплатина 4 мг/кг, для фарморубицина – 5 мг/кг. Контрольные животные (n = 50) получали эквиобъемное количество растворителя. Нейпоген и имГ-КСФ вводили подкожно на второй день после введения цитостатиков курсом 5 дней в дозе 100 мкг/кг. На 2, 5, 10, 15 и 20-е сутки после инъекций цитостатиков определяли активность в сыворотке крови крыс аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), щелочной фосфатазы (ЩФ) и гамма-глутамилтрансферазы (ГГТ) по стандартным методикам, используя полуавтоматический биохимический анализатор Согmау, наборы фирм Согmау и «Вектор Бест» [15]. Для патоморфологического исследования образцы печени помещали в фиксатор Карнуа. Морфометрический анализ площади воспалительной инфильтрации печеночной ткани, подсчет количества двуядерных и гепатоцитов с пикнотизированными ядрами проводили на препаратах, окрашенных гематоксилином и эозином с помощью компьютерной программы ImageJ. Для оценки накопления гликогена в печени использовали гистохимическую окраску по Мак-Манусу [16][17].
Статистическую обработку материала проводили с использованием непараметрического U-критерия Манна – Уитни (программа статистического анализа StatPlus Pro (AnalystSoft Inc.) Версия 5.9) [18].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Введение противоопухолевых препаратов неизменно вызывает токсические реакции в организме экспериментальных животных. На рис. 1 показано возрастание активности печеночных ферментов в ответ на введение цисплатина и фарморубицина. Активность АлАТ повышалась на 2, 10 и 15-е сутки наблюдения, АсАТ – на 5-е сутки, ЩФ – на 2, 5, 10, 15, 20-е сутки, ГГТ – на 2, 5, 15 и 20-е сутки после применения цисплатина. После использования фарморубицина наблюдалось повышение уровня АлАТ на 2, 10 и 20-е сутки наблюдения, АсАТ – на 5 и 10-е сутки, ЩФ – на 10, 20-е сутки, ГГТ – во все сроки эксперимента (рис. 1, А–Г).
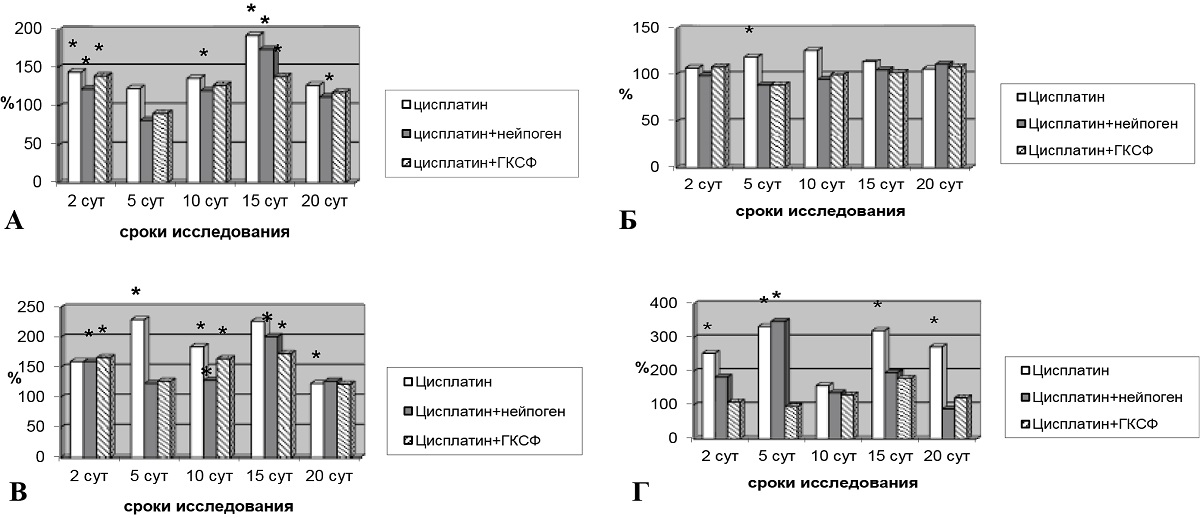
Рис. 1. Активность ферментов после введения цисплатина и корректоров:
А – активность АлАТ после введения цисплатина и корректоров;
Б – активность АсАТ после введения цисплатина и корректоров;
В – активность ЩФ после введения цисплатина и корректоров;
Г – активность ГГТ после введения цисплатина и корректоров
Примечание: * – различия при сравнении экспериментальных групп с группой контроля статистически значимы при р < 0,05.
Составлено авторами.
Оценка активности аминотрансфераз, как известно, доминирует в ферментодиагностике патологии печени. Возросший уровень активности в сыворотке крови АлАТ свидетельствует о повышении проницаемости плазматических мембран гепатоцитов, а также о деструкции клеток печени и субклеточных образований под влиянием токсического агента. Степень подъема активности аминотрансфераз свидетельствует о выраженности цитолитического синдрома [19]. Реактивные изменения эпителия желчевыводящих путей, явления внутрипеченочного холестаза отражают активность ГГТ [19]. Для коррекции выявленных нарушений животные получали курс инъекций препарата имГ-КСФ или нейпогена соответственно.
После введения нейпогена на фоне действия цисплатина отмечен эффект коррекции токсичности цитостатика: активность АлАТ снижалась на 5, 10 и 20-е сутки, АсАТ – во все сроки опыта, ГГТ – на 2, 10, 15 и 20-е сутки. Величина активности ЩФ на 10-е сутки была ниже, чем у животных, получавших цисплатин. Использование им-ГКСФ также приводило к нормализации ферментативных показателей. Так, у животных, получавших препарат имГ-КСФ после цисплатина, отмечено уменьшение активности АлАТ до уровня контрольных показателей на 5, 10 и 20-е сутки, АсАТ – на 5 и 10-е сутки, ЩФ – на 20-е сутки, ГГТ – во все сроки опыта. Следует отметить, что на 5-е сутки исследования после действия имГ-КСФ все ферментные показатели были достоверно ниже, чем в группе животных, получавших только инъекции цисплатина (рис. 1).
При использовании рекомбинантных форм ГКСФ также уменьшалось токсическое действие фарморубицина на печень экспериментальных животных. Применение имГ-КСФ значительно улучшало показатели АлАТ и АсАТ практически во все сроки исследования, ЩФ – на 20-е сутки, ГГТ – на 15 и 20-е сутки. У крыс, получавших в качестве корректора нейпоген, уменьшалась активность АлАТ и АсАТ (10-е сутки); активность ЩФ, ГГТ снижалась на 15 и 20-е сутки опыта. Также отмечены статистически значимые различия уровня активности ферментов между группами животных, получавших только цитостатик и получавших фарморубицин и корректоры. На 10-е сутки наблюдения такие различия отмечены для АлАТ и АсАТ (фарморубицин+нейпоген) и для АсАТ и ЩФ (фарморубицин+имГ-КСФ) (рис. 2).
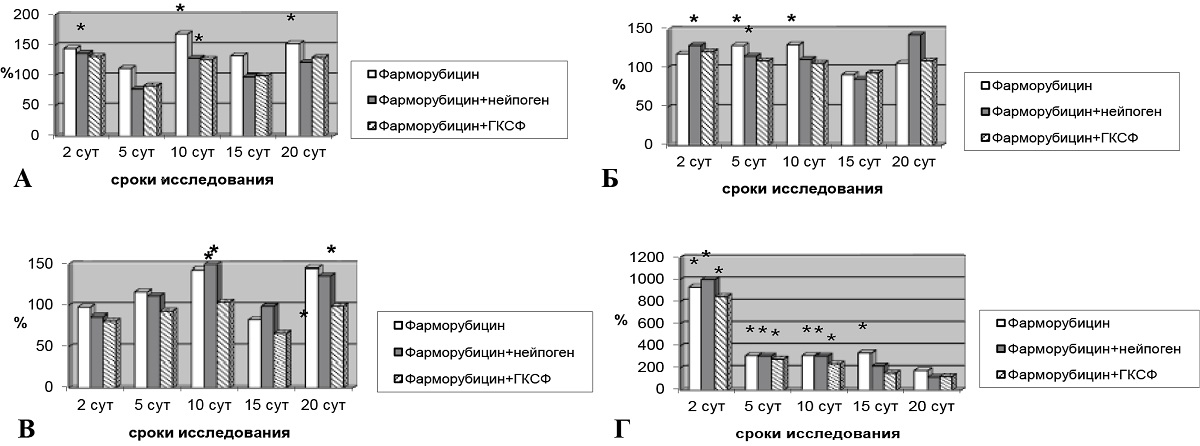
Рис. 2. Активность ферментов после введения фарморубицина и корректоров:
А – активность АлАТ после введения фарморубицина и корректоров;
Б – активность АсАТ после введения фарморубицина и корректоров;
В – активность ЩФ после введения фарморубицина и корректоров;
Г – активность ГГТ после введения фарморубицина и корректоров
Примечание: * – различия при сравнении экспериментальных групп с группой контроля статистически значимы при р < 0,05.
В результате гистологического исследования было выявлено, что у крыс после парентерального введения фарморубицина и цисплатина развивалось токсическое повреждение паренхимы печени, протекающее по типу острого гепатита. Отмечались гиперемия сосудов, дистрофические и некротические изменения гепатоцитов, воспалительная инфильтрация паренхимы печени.
В печени крыс после инъекций цисплатина и фарморубицина обнаруживались гепатоциты с пикнотизированными ядрами. Увеличение их количества фиксировалось преимущественно со 2-х по 15-е сутки и характеризовало высокую интенсивность деструктивных процессов в паренхиме печени. Данный факт подтверждался нарастанием активности АлТ, АсТ в сыворотке крови крыс в этот период нарастала [19]. В группе животных, получавших цисплатин, количество некротизированных гепатоцитов достигало максимальных значений на 5–10-е сутки эксперимента и нормализовалось к 20-м суткам. При введении фарморубицина данный показатель был наиболее высоким на 10-е сутки и не снижался до контрольных значений до конца наблюдения. В участках некроза наблюдались скопления воспалительных клеток, представленные преимущественно лимфомакрофагальными элементами. Степень инфильтрации была наиболее высокой на 5-е сутки после введения фарморубицина и на 10-е сутки после введения цисплатина – период максимально выраженных изменений, что свидетельствовало об интенсивном воспалительном процессе в паренхиме печени [20]. Отмечено также нарушение регенераторных процессов, о чем можно было судить по снижению количества двуядерных гепатоцитов со 2-х по 10-е сутки при введении цисплатина, тогда как при введении фарморубицина данный показатель не восстанавливался до конца наблюдения. Введение фарморубицина и цисплатина в МПД приводило к развитию метаболических нарушений в печени крыс. Качественное гистохимическое исследование печеночной ткани выявило исчезновение зернистой фракции гликогена из цитоплазмы гепатоцитов животных, получавших противоопухолевые препараты со 2-х по 15-е сутки.
ИмГ-КСФ и нейпоген использованы как корректоры токсического действия цисплатина и фарморубицина на морфофункциональное состояние печени крыс. В группе животных, получавших фарморубицин, введение рекомбинантных препаратов приводило к значительному снижению количества гепатоцитов с некрозом начиная с 5-х суток, а в группе с цисплатином – с 10-х суток эксперимента. Применение препаратов имГ-КСФ уменьшало выраженность воспалительной инфильтрации паренхимы печени крыс, вызывало увеличение количества двуядерных гепатоцитов у крыс, получавших корректоры с 10-х суток в группе с цисплатином и с 15-х суток в группе с фарморубицином, что свидетельствовало о развитии регенераторных процессов в печени животных.
Таким образом, после однократного введения фарморубицина и цисплатина в МПД в печени крыс развивался острый токсический гепатит. Использование имГ-КСФ и нейпогена уменьшало гепатотоксичность цисплатина и фарморубицина, стимулировало регенерацию ткани печени. По ряду определяемых показателей им-ГКСФ даже превосходил нейпоген, в частности, в более ранние сроки отмечено восстановление морфологического состояния печени крыс.
ЗАКЛЮЧЕНИЕ
Однократное введение в максимально переносимой дозе противоопухолевых препаратов цисплатина (4 мг/кг, внутривенно) и фарморубицина (5 мг/кг, внутривенно) вызывало значительные нарушения метаболизма в печени крыс: статистически значимое повышение активности ферментов (аминотрансфераз, ГГТ). Морфологические исследования выявили изменения, характерные для токсического гепатита, наиболее выраженные на 5, 10-е сутки после введения препарата и сохраняющиеся до 30-х суток эксперимента.
Применение им-ГКСФ в эксперименте выявило эффект снижения гепатотоксического действия антибластомных препаратов. При использовании имГКСФ пятикратно подкожно в дозе 100 мкг/кг у крыс, которым были введены цисплатин и фарморубицин в максимально переносимой дозе, значения активности печеночных ферментов стремились к норме, а патоморфологическое изучение ткани печени показало нарастание процессов восстановления гепатоцитов.
Список литературы
1. Богуш Т. А., Богуш Е. А., Степанов А. А. Современные подходы к повышению эффективности противоопухолевой химиотерапии путем индивидуальной оптимизации лечения и избирательного снижения побочных токсических проявлений цитостатиков // Антибиотики и химиотерапия. 2000. № 1. С. 32–38.
2. Руководство по химиотерапии опухолевых заболеваний / под ред. Н. И. Переводчиковой. М. : Практическая медицина, 2005. 699 с.
3. Nurgali K., Jagoe R. T., Abalo R. Editorial: Adverse effects of cancer chemotherapy: Anything new to improve tolerance and reduce sequelae? // Frontiers in Pharmacology. 2018. Vol. 9. 3 p. https://doi.org/10.3389/fphar.2018.00245.
4. Карпова Г. В., Фомина Т. И., Ветошкина Т. В. и др. Гепатотоксичность противоопухолевых препаратов // Вестник Российской академии медицинских наук. 2009. № 11. С. 17–21.
5. Иваников И. О., Виноградова Н. Н., Крашенков О. П. и др. Острые повреждения печени вследствие химиотерапии и возможности их лечения // Доказательная гастроэнтерология. 2020. Т. 9, № 4. С. 7–15. https://doi.org/10.17116/dokgastro202090417.
6. Снеговой А. В., Давыдов М. И. Современные возможности поддерживающей терапии лекарственного противоопухолевого лечения // Вестник РОНЦ им. Н. Н. Блохина РАМН. 2016. Т. 27, № 2. С. 5–16.
7. Петрова Г. Д., Чернявская Т. З., Горбунова Н. В. и др. Эффективность липэгфилграстима при нейтропении, индуцированной химиотерапией // Онкогематология. 2015. Т. 10, № 4. С. 38–43. https://doi.org/10.17650/1818- 8346-2015-10-4-38-43.
8. Сакаева Д. Д. Методы коррекции токсической нейтропении при комбинированной химиотерапии злокачественных опухолей // Российский биотерапевтический журнал. 2003. Т. 2, № 2. С. 39–46.
9. Welte K., Gabrilove J., Bronchud M. H. et al. Filgrastime (r-metHuGCSF): The first 10 years // Blood. 1996. Vol. 88, no. 6. P. 1907–1929. http://dx.doi.org/10.118/blood.V88.6.1907.bloodjournal8861907.
10. Дыгай А. М., Жданов В. В., Зюзьков Г. Н. и др. Механизмы гепатопротективного действия иммобилизированного гранулоцитарного колониестимулирующего фактора // Бюллетень экспериментальной биологии и медицины. 2011. Т. 150, № 10. С. 371–375.
11. Дыгай А. М., Жданов В. В., Зюзьков Г. Н. и др. Гепатопротекторные эффекты иммобилизированных препаратов гранулоцитарного колониестимулирующего фактора и гиалуронидазы и механизмы их развития // Клеточные технологии в биологии и медицине. 2012. № 1. С. 14–18.
12. Сотникова Н. В., Ставрова Л. А., Гурьянцева Л. А. и др. Механизмы влияния гранулоцитарного КСФ на восстановление поврежденной ткани при хроническом поражении печени СCl4 // Клеточные технологии в биологии и медицине. 2005. № 4. С. 243–246.
13. Арзамасцев Е. В., Березовская И. В., Гуськова Т. А. и др. Особенности оценки токсичности воспроизведенных лекарственных средств // Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М. : Гриф и К, 2012. С. 35–36.
14. Беленький М. М. Элементы количественной оценки фармакологического эффекта. 2-е изд., перераб. и доп. Л. : Медгиз, 1963. 152 с.
15. Камышников В. С., Клинико-биохимическая лабораторная диагностика. В 2 т. 2-е изд. Минск : Интерпрессервис, 2003. Т. 1. 495 с.
16. Меркулов Г. А. Курс патогистологической техники. 5-е изд., испр. и доп. Л. : Медицина. Ленинградское отделение, 1969. 423 с.
17. Долгушин М. В., Васильева Л. С., Малиновская Н. А. Практическая гистология. Гистохимия. М. : ГЭОТАР-Медиа, 2021. 96 с.
18. Фадейкина О. В., Волкова Р. А., Карпова Е. В. Статистическая обработка результатов аттестации биологических стандартных образцов: применение критерия Манна – Уитни // Химико-фармацевтический журнал. 2019. Т. 53, № 7. С. 54–58. https://doi.org/10.30906/0023-1134-2019-53-7-54-58.
19. Доскалиев Ж. А., Туганбекова С. К., Калиаскарова К. С. Биохимические «печеночные» тесты: критерии эффективности клеточной терапии // Journal of Clinical Medicine of Kazakhstan. 2011. № 2. С. 13–17.
20. Зобнин Ю. В. Токсическое повреждение печени у детей // Сибирский медицинский журнал (Иркутск). 2017. Т. 151, № 4. С. 37–53.
Об авторах
Т. Ю. ДубскаяРоссия
кандидат медицинских наук, старший научный сотрудник
Т. В. Ветошкина
Россия
кандидат биологических наук, старший научный сотрудник
Л. А. Сандрикина
Россия
кандидат медицинских наук, научный сотрудник
Т. И. Фомина
Россия
кандидат медицинских наук, старший научный сотрудник
Е. П. Федорова
Россия
кандидат медицинских наук, научный сотрудник
П. Г. Мадонов
Россия
доктор медицинских наук, профессор
А. А. Чурин
Россия
доктор медицинских наук, профессор РАН
Рецензия
Для цитирования:
Дубская Т.Ю., Ветошкина Т.В., Сандрикина Л.А., Фомина Т.И., Федорова Е.П., Мадонов П.Г., Чурин А.А. СНИЖЕНИЕ ГЕПАТОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ С ПРИМЕНЕНИЕМ ИММОБИЛИЗИРОВАННОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА. Вестник СурГУ. Медицина. 2025;18(3):85-91. https://doi.org/10.35266/2949-3447-2025-3-11
For citation:
Dubskaya T.Yu., Vetoshkina T.V., Sandrikina L.A., Fomina T.I., Fedorova E.P., Madonov P.G., Churin A.A. CORRECTION OF ANTINEOPLASTIC DRUGS INDUCED HEPATOTOXICITY USING IMMOBILIZED GRANULOCYTE-COLONY STIMULATING FACTOR. Vestnik SurGU. Meditsina. 2025;18(3):85-91. (In Russ.) https://doi.org/10.35266/2949-3447-2025-3-11




















