Перейти к:
ДИАГНОСТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, АССОЦИИРОВАННОГО С БЕРЕМЕННОСТЬЮ
https://doi.org/10.35266/2949-3447-2025-2-9
Аннотация
В статье рассматривается диагностика рака молочной железы, ассоциированного с беременностью. Отмечается рост заболеваемости раком молочной железы среди женщин репродуктивного возраста, что связано с более поздним возрастом деторождения. Беременность осложняет диагностику из-за физиологических и гормональных изменений в молочной железе. Основные методы диагностики включают ультразвуковое исследование и биопсию. Приведены клинические случаи, демонстрирующие важность раннего обнаружения и комплексного подхода к лечению. Лечение требует мультидисциплинарного подхода, учитывающего безопасность матери и плода.
Ключевые слова
Для цитирования:
Белоцерковцева Л.Д., Климова Н.В., Кузнецов А.А. ДИАГНОСТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, АССОЦИИРОВАННОГО С БЕРЕМЕННОСТЬЮ. Вестник СурГУ. Медицина. 2025;18(2):65-72. https://doi.org/10.35266/2949-3447-2025-2-9
For citation:
Belotserkovtseva L.D., Klimova N.V., Kuznetsov A.A. PREGNANCY ASSOCIATED BREAST CANCER DIAGNOSTICS. Vestnik SurGU. Meditsina. 2025;18(2):65-72. (In Russ.) https://doi.org/10.35266/2949-3447-2025-2-9
ВВЕДЕНИЕ
Анализ данных отечественной статистики демонстрирует значительный рост заболеваемости раком молочной железы (РМЖ): за последние десять лет показатель увеличился на 32,5 %, при этом наблюдается тенденция к раннему выявлению патологии у молодых женщин. В глобальном контексте РМЖ остается одной из наиболее распространенных форм онкологических заболеваний, диагностируемых у беременных [1]. Так, согласно исследованиям H. Sung, в США РМЖ лидирует среди злокачественных новообразований, выявляемых у будущих матерей [2]. Стоит отметить, что сочетание РМЖ и беременности, ранее считавшееся редкостью, становится все более актуальным. Это связано с двумя основными факторами: отсрочкой деторождения и расширением критериев диагностики, включающих период до года после родов. Однако ограничения в применении стандартных методов скрининга (например, маммографии) часто задерживают установление диагноза, что негативно сказывается на прогнозе. При этом своевременное лечение не влияет на выживаемость матери и ребенка, если проводится адекватная тактика ведения. В настоящее время используется термин «РМЖ, ассоциированный с беременностью», который охватывает три клинические ситуации:
- Диагностика опухоли во время беременности.
- Выявление рака в период лактации.
- Обнаружение заболевания в течение первого года после родов.
Несмотря на это, специалисты все чаще отказываются от универсального понятия в пользу более конкретных классификаций («РМЖ во время беременности» и «послеродовой РМЖ»), что обусловлено различиями в диагностических и терапевтических подходах. Эпидемиологические данные указывают на частоту РМЖ у беременных от 1 случая на 3000 до 1 на 10 000 беременностей [3]. Возникновение патологии связывают с несколькими механизмами [4]:
- Гормональные изменения: высокие концентрации эстрогенов, инсулиноподобного фактора роста и других медиаторов стимулируют пролиферацию клеток молочной железы (МЖ), потенциально способствуя канцерогенезу.
- Иммунологические нарушения: беременность характеризуется угнетением иммунитета, включая снижение активности естественных киллеров и Т-лимфоцитов, что может создавать благоприятную среду для опухолевого роста.
- Инволюция ткани МЖ: процессы апоптоза и ремоделирования стромы после родов могут иметь проонкогенный эффект.
Клинические особенности РМЖ у беременных включают высокую долю агрессивных форм (до 74 % недифференцированных опухолей), частое вовлечение лимфатических узлов (88 % случаев) и метастазирование. Опухоли, возникающие во время беременности, отличаются повышенной экспрессией протеолитических ферментов, усиливающих инвазию и метастазирование. Гистологически преобладают протоковые аденокарциномы, часто HER2-позитивные или трипл-негативные варианты [5].
Особенности карцином, ассоциированных с беременностью:
– более 50 % случаев представлены низкодифференцированными опухолями, которые отличаются более агрессивным течением и прогнозом;
– более 50 % наблюдается вовлечение лимфоузлов;
– диагностируются на более поздних стадиях;
– неблагоприятный прогноз;
– часто рецидив в течение 2–3 лет после диагноза.
Беременность вносит дополнительные сложности в диагностику РМЖ. Физиологические изменения в МЖ, такие как увеличение размера и изменение плотности тканей, могут затруднить выявление опухолей как при самообследовании, так и при клинических исследованиях. Имеются особенности физиологических изменений МЖ во время беременности и связанных с ними результатами визуализации. Продукция эстрогена и прогестерона желтым телом в течение первого триместра беременности и плацентой во втором триместре приводит к пролиферации и развитию долек и протоков, инволюции жировой ткани и увеличению васкуляризации МЖ. Пролиферативный процесс наиболее выражен в течение первых 20 недель беременности. Рост дольки продолжается во 2-м и 3-м триместрах путем клеточной пролиферации, а также увеличения размера клеток [6]. Во 2-м триместре секреторные вещества накапливаются в эпителиальных клетках дольки ацинуса, а в 3-м триместре повышенные уровни пролактина способствуют дифференцировке альвеолярных клеток и запускают лактогенез. Во второй половине беременности пролиферативный процесс замедляется и изменения в протоках, участвующих в выработке молока, увеличиваются. Размер дольки увеличивается, и межлобулярная жировая ткань исчезает, пока дольки не разделяются только тонкими слоями соединительной ткани. Во время беременности изменения в протоках не происходят равномерно. Структура МЖ во время беременности изменена. Пальпаторно она становится более неоднородной и «зернистой», а, следовательно, физикальное определение в ней объемных образований крайне затруднено. Маммографическая плотность МЖ на фоне беременности резко возрастает. Это исключает маммографию из числа основных методов диагностики образований в МЖ во время беременности. Маммография при беременности существенного диагностического значения не имеет, так как в 25 % случаев дает ложноотрицательный результат. Кроме того, нельзя не брать во внимание и лучевую нагрузку, которая очень мала (0,004 Гр), но тем не менее совершенно не желательна [7].
Проведение лучевых исследований во время беременности, за исключением особых случаев, необходимо избегать. На это обращают внимание целый ряд исследователей. Американский колледж радиологов не рекомендует использовать МРТ в качестве основного метода в диагностике заболеваний МЖ во время беременности, также не следует использовать контрастные вещества [8]. Вместе с тем Европейский комитет по радиационному риску утверждает, что контрастные препараты на основе гадолиния можно использовать во время беременности, т. к. он незначительно поступает в плаценту и быстро выводится почками. И тем не менее у женщин в 1-м триместре беременности МРТ целесообразно использовать с осторожностью из-за теоретического риска нагревания и кавитации эмбриона. У беременных УЗИ, дополненное биопсией, становится методом выбора в диагностике объемных образований МЖ. Стандартное УЗИ в сочетании с цветной и энергетической допплерографией в 97 % позволяет дифференцировать кистозное и солидное образование [9]. Окончательная верификация природы узлового образования должна осуществляться с помощью пункционной биопсии под УЗ-контролем. «Core»-биопсия позволяет установить диагноз, а также выполнить целый набор иммуногистохимических исследований. Кроме того, вакуумная аспирационная биопсия под УЗ-контролем и предоперационная разметка – маркировка непальпируемых образований – также могут быть использованы на фоне беременности. Цитологическое исследование менее эффективно из-за большого числа ложноположительных результатов во время беременности.
Цель – предикция и превенция рака молочной железы во время беременности и после родов.
МАТЕРИАЛЫ И МЕТОДЫ
С разрешения этического комитета Сургутского государственного университета представлено несколько клинических примеров, демонстрирующих запущенные случаи РМЖ у беременных и кормящих пациенток. Верификация проводилась малоинвазивными интервенционными методами.
Клинический пример 1
Пациентка, 36 лет, на 2-м триместре беременности, обнаружила у себя пальпируемое образование в левой МЖ, которое увеличилось за последние три месяца. При проведении комплексного обследования у онкомаммолога по данным УЗИ и маммографии выявлено образование левой МЖ (рис. 1 а, б). Была проведена чрескожная биопсия с тройным отрицательным результатом – высокодифференцированная инфильтрирующая протоковая карцинома.

Рис. 1. Мультимодальная визуализация МЖ с признаками злокачественного новообразования:
а) эхограмма левой МЖ, определяется гипоэхогенное узловое образование с микромодулированными краями 2,8 см, периферическим кровотоком;
б) рентгенограмма левой МЖ в косой проекции, определяется узел повышенной плотности с неровными краями (синяя стрелка), который вызывает втяжение кожи
Примечание: составлено авторами по источнику [10].
Клинический пример 2
Пациентка, 35 лет, находящаяся в послеродовом периоде, обнаружила у себя пальпируемое образование в правой МЖ. Комплексное обследование у онкомаммолога подтвердило наличие объемного образования правой МЖ с признаками злокачественности (рис. 2 а, б). Была проведена чрескожная биопсия, в результате которой была обнаружена умеренно дифференцированная инфильтрирующая протоковая карцинома.

Рис. 2. Мультимодальная визуализация МЖ с признаками злокачественного новообразования:
а) рентгенограмма правой МЖ в косой проекции в ретроареолярной области определяется очень плотное узловое образование со спикулообразными краями (синяя стрелка), отмечается утолщение и втяжение кожи;
б) эхограмма правой МЖ, определяется гипоэхогенное образование размером 5 см с шиповидными краями
Примечание: составлено авторами.
Клинический пример 3
У 38-летней пациентки с 1-го триместра беременности в обеих МЖ появились пальпируемые образования, которые она обнаружила сама. После лучевого исследования (рис. 3 а–г) была проведена двусторонняя чрескожная биопсия. Выявлена атипичная гиперплазия правой МЖ, инфильтрирующая дольковая карцинома левой МЖ.
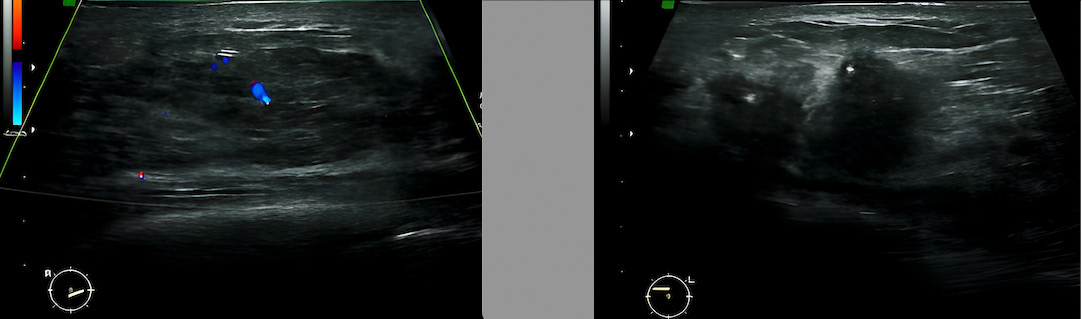
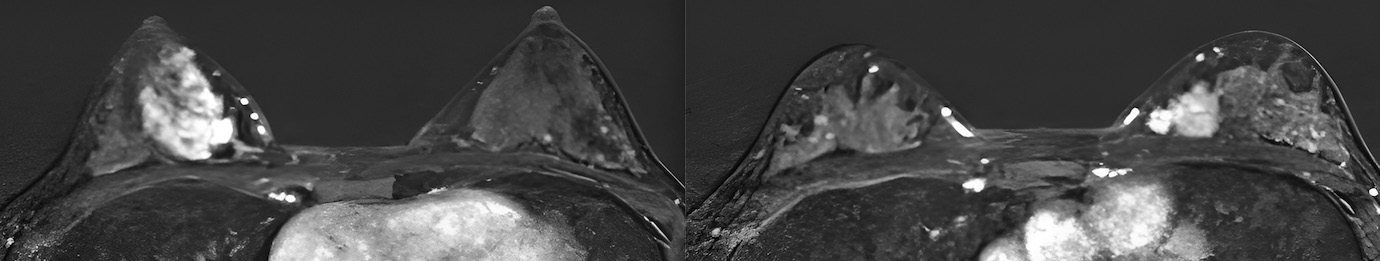
Рис. 3. Мультимодальная визуализация МЖ с признаками злокачественных новообразований:
а) эхограмма правой МЖ, определяется изоэхогенное узловое образование с нечеткими границами и кровотоком;
б) эхограмма левой МЖ, во внутреннем квадранте определяется гипоэхогенное узловое образование с неровными краями без эхогенной псевдокапсулы;
в) Т1 ВИ гиперинтенсивное бугристое образование правой МЖ;
г) Т1 ВИ патологическое гиперинтенсивное узловое образование левой МЖ, расположено медиально
Примечание: составлено авторами.
Все три пациентки находились в периоде, связанном с беременностью и родами, что осложняет диагностику и лечение из-за гормональных и физиологических изменений в МЖ. Беременность и послеродовой период маскируют симптомы и влияют на результаты обследований. Обнаружение пальпируемых образований в МЖ всегда требует внимательного обследования. В первом случае образование было обнаружено в послеродовом периоде, во втором – во время беременности, а в третьем – в обеих МЖ у беременной пациентки. Проводилось комплексное обследование, которое включало клинический осмотр, маммографию, УЗИ, МРТ. Эти методы помогли определить характер образования и наличие признаков злокачественности [11]. В первом случае обследование подтвердило наличие объемного образования с признаками злокачественности. Во втором случае УЗИ и маммография выявили образование, а в третьем – лучевое исследование показало различные характеристики образований в правой и левой МЖ. Поводилась чрескожная биопсия. Она является стандартным методом для подтверждения диагноза [12][13]. В первом случае биопсия выявила умеренно дифференцированную инфильтрирующую протоковую карциному. Во втором случае – высокодифференцированную инфильтрирующую протоковую карциному с тройным отрицательным результатом. В третьем случае биопсия показала атипичную гиперплазию правой МЖ и инфильтрирующую дольковую карциному левой МЖ.
Типы опухолей и их особенности:
- Инфильтрирующая протоковая карцинома: наиболее распространенный тип РМЖ. Умеренная дифференцировка указывает на среднюю степень агрессивности опухоли, а высокая дифференцировка – на более благоприятный прогноз. Тройной отрицательный статус осложняет лечение, так как ограничивает возможности для гормональной терапии.
- Инфильтрирующая дольковая карцинома: редкий тип, который обычно имеет более благоприятный прогноз по сравнению с инфильтрирующей протоковой карциномой.
- Атипичная гиперплазия: предраковое состояние, требующее наблюдения и, возможно, дополнительного лечения для предотвращения перехода в рак.
Лечение РМЖ требует мультидисциплинарного подхода, включающего привлечение онкологов, хирургов, радиологов и других специалистов [14]. В случае беременности важно учитывать безопасность матери и плода. Лечение может включать хирургическое вмешательство (например, лампэктомию или мастэктомию), химиотерапию, лучевую терапию и гормональную терапию в зависимости от стадии заболевания и биологических характеристик опухоли. В случае атипичной гиперплазии может быть рекомендовано наблюдение или хирургическое удаление пораженной ткани. Важно обеспечить пациенткам психологическую поддержку, особенно учитывая, что они находятся в послеродовом периоде или беременности, что может добавить эмоциональный стресс. Таким образом, эти клинические случаи подчеркивают важность раннего обнаружения и комплексного подхода к диагностике и лечению РМЖ у женщин в различных физиологических состояниях. Каждый случай требует индивидуального подхода, учитывающего как состояние пациентки, так и безопасность плода при необходимости.
После лечения РМЖ, связанного с беременностью, некоторые женщины хотят забеременеть в будущем. По мере увеличения среднего возраста материнства все большее число молодых женщин после лечения РМЖ считают свои семьи без детей неполноценными. В то же время безопасность беременности после РМЖ была продемонстрирована в ходе таких исследований, как POSTIVE [15]. Отсутствуют однозначные доказательства, которые могли бы помочь этим пациенткам в принятии решений.
Следующий клинический пример демонстрирует непредсказуемость течения РМЖ на фоне беременности.
Клинический пример 4
Пациентка 1985 г. р. в 2019 г. заболела раком правой МЖ. Был выставлен диагноз: рак правой МЖ T1 с N1 M0, стадия 2A. Опухоль была небольшой (до 2 см), но уже имелись метастазы в регионарные лимфоузлы, без отдаленных метастазов.
Проведено лечение: 12.02.2019 – справа радикальная мастэктомия по Маддену. Это стандартная операция для удаления опухоли и регионарных лимфоузлов. Лечение дополнено: ДЛТ 03.2019, АПХТ (4 к. АС + 4 к. паклитаксел), гормонотерапия Тамоксифеном с 03.2019 по 15.12.2022. Адъювантная химиотерапия и гормонотерапия были направлены на снижение риска рецидива. 18.02.2021 – отсроченная реконструкция правой МЖ кожно-мышечным лоскутом с использованием эндопротеза. Был выполнен важный этап для восстановления качества жизни пациентки после мастэктомии.
Пациентка запланировала беременность, прошла комплексное обследование, патологий не выявлено, что позволило ей рассмотреть возможность беременности. Консультация в НМИЦ онкологии им. Н. Н. Блохина: рекомендовано узнать патогенность мутации и класс патогенности, а также отмена Тамоксифена за 3–6 месяцев до беременности. Это необходимый шаг, т. к. Тамоксифен может быть тератогенным и влиять на развитие плода. Проведены анализы на генетические мутации: мутации в генах BRCA1, 2, CHEK2, BLM не обнаружены. Они важны, т. к. мутации в этих генах связаны с высоким риском РМЖ и других видов рака. Обнаружена мутация NBS1 657del5. Эта мутация связана с синдромом Неймегена, который может повышать риск рака, но не так сильно, как мутации в BRCA1/2.
Пациентка забеременела, но на 5-м месяце беременности обнаружила пальпируемое образование в области грудины. Этот тревожный симптом потребовал немедленного обследования. Комплексное обследование выявило прогрессирование заболевания в виде метастазов в грудину, множественных метастазов в кости скелета и печень (рис. 4). Подтверждено агрессивное течение заболевания.
Лечение начато на фоне беременности: Рибоциклиб, Гозерелин, Анстрозол с 04.2024, Золедроновая кислота с 03.2024. Эти препараты используются для лечения метастатического РМЖ, но их применение на фоне беременности требует тщательного контроля и оценки рисков для плода. Клиническая группа II: умеренно дифференцированная карцинома неспецифического типа, Эр-80–90 %, Пр-90–100 %, HER2/NEU-отр., KI-40–50 %. т. е. получены признаки гормонозависимой опухоли с высокой пролиферативной активностью.

Рис. 4. Мультиспиральная компьютерная томография при диссеминированном злокачественном процессе – мультипланарные и объемные реконструкции:
а) мультипланарная реконструкция выделенной области МСКТ, определяются очаги деструкции тела и рукоятки грудины;
б) мультипланарная реконструкция МСКТ в сагиттальной плоскости, определяются очаги деструкции в грудине и 4-м поясничном позвонке, а также склеротические очаги в грудных и поясничных позвонках;
в) объемная реконструкция МСКТ, слева визуализируется большой остеолитический очаг в крыле подвздошной кости;
г) МПР печени в аксиальной проекции, определяются гиповаскулярные вторичные очаги
Примечание: составлено авторами.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Клинический случай 4 показывает несколько ключевых аспектов:
- Раннее обнаружение и адекватное лечение РМЖ являются критически важными для улучшения прогноза. В данном случае пациентка прошла стандартное лечение, включая хирургическое вмешательство, химиотерапию и гормонотерапию.
- Планирование беременности после лечения РМЖ требует тщательного обследования и консультации с онкологами. Важно учитывать возможные риски для плода и матери, а также необходимость отмены гормонотерапии перед беременностью.
- Генетическое тестирование играет важную роль в оценке риска рецидива и планировании дальнейшего лечения. В данном случае мутация NBS1 657del5 была выявлена, что может иметь значение для дальнейшего наблюдения и лечения.
- Лечение метастатического РМЖ на фоне беременности представляет собой сложную задачу, требующую мультидисциплинарного подхода. Важно учитывать как состояние пациентки, так и безопасность плода при выборе терапии.
- Междисциплинарный подход к диагностике и лечению РМЖ на фоне беременности и после родов обязателен.
- Психологическая поддержка является важным компонентом лечения, особенно в условиях беременности и прогрессирования заболевания. Пациенткам необходимо предоставлять доступ к психологической помощи и поддержке.
ЗАКЛЮЧЕНИЕ
Учитывая, что во время беременности состояние плода и матери находится под наблюдением акушера-гинеколога, должно уделяться внимание и состоянию МЖ. Своевременная и качественная диагностика, а также мультидисциплинарный подход к лечению РМЖ у беременных женщин являются ключевыми факторами для улучшения прогноза и минимизации рисков для матери и плода.
Список литературы
1. Волочаева М. В., Шмаков Р. Г. Беременность и рак молочной железы: тактика ведения беременности, особенности диагностики и лечения // Эффективная фармакотерапия. 2013. № 28. С. 6–9.
2. Sung H., Siegel R. L., Rosenberg P. S. et al. Emerging cancer trends among young adults in the USA: Analysis of a population-based cancer registry // The Lancet. Public Health. 2019. Vol. 4, no. 3. P. E137–E147. https://doi.org/10.1016/s2468-2667(18)30267-6.
3. Иванова О. А., Жильцова Е. К., Иванов В. Г. и др. Рак молочной железы и беременность: особенности диагностики и лечения // Злокачественные опухоли. 2014. № 1. С. 14–18. https://doi.org/10.18027/2224-5057-2014-1-14-18.
4. Загаштокова А. К., Пароконная А. А., Петровский А. В. и др. Рак молочной железы во время беременности: диагностика и лечение. Обзор литературы // Онкогинекология. 2023. № 3. С. 4–16.
5. Чернышова А. Л., Черняков А. А., Горбуков Е. Ю. и др. Сочетание беременности и рака молочной железы // Опухоли женской репродуктивной системы. 2023. Т. 19, № 3. С. 85–91. https://doi.org/10.17650/1994-4098-2023-19-3-85-91.
6. Якушевская О. В., Юренева С. В., Ашрафян Л. А. и др. Контрацепция у пациенток с отягощенным онкологическим анамнезом: рак молочной железы и гинекологический рак (часть I) // Акушерство и гинекология. 2022. № 11. С. 45–51. https://doi.org/10.18565/aig.2022.11.45-51.
7. Andersson T. M.-L., Johansson A. L. V., Hsieh C.-C. et al. Increasing incidence of pregnancy-associated breast cancer in Sweden // Obstetrics & Gynecology. 2009. Vol. 114, no. 3. P. 568–572. https://doi.org/10.1097/AOG.0b013e3181b19154.
8. Gradishar W. J., Moran M. S., Abraham J. et al. Breast Cancer, Version 3.2024, NCCN Clinical Practice Guidelines in Oncology // Journal of the National Comprehensive Cancer Network. 2024. Vol. 22, no. 5. P. 331–357. https://doi.org/10.6004/jnccn.2024.0035.
9. Doll A., Kapoor N. S. ASO author reflections: First descriptions of patients with pregnancy associated breast cancer and subsequent pregnancy // Annals of Surgical Oncology. 2024. Vol. 31. P. 7547–7548. https://doi.org/10.1245/s10434-024-15854-0.
10. Kieturakis A. J., Wahab R. A., Vijapura C. et al. Current recommendations for breast imaging of the pregnant and lactating patient // American Journal of Roentgenology. 2021. Vol. 216, no. 6. P. 1462–1475. https://doi.org/10.2214/AJR.20.23905.
11. Lambertini M., Blondeaux E., Bruzzone M. et al. Pregnancy after breast cancer: A systematic review and meta-analysis // Journal of Clinical Oncology. 2021. Vol. 39, no. 29. P. 3293–3305. https://doi.org/10.1200/JCO.21.00535.
12. Loibl S., Azim H. A., Bachelot T. et al. ESMO Expert Consensus Statements on the management of breast cancer during pregnancy (PrBC) // Annals of Oncology. 2023. Vol. 34, no. 10. P. 849–866. https://doi.org/10.1016/j.annonc.2023.08.001.
13. Loibl S., Schmidt A., Gentilini O. et al. Breast cancer diagnosed during pregnancy: Adapting recent advances in breast cancer care for pregnant patients // JAMA Oncology. 2015. Vol. 1, no. 8. P. 1145–1153. https://doi.org/10.1001/jamaoncol.2015.2413.
14. Partridge A., Pagani O., Niman S. M. et al. Abstract GS4-09: Pregnancy Outcome and Safety of Interrupting Therapy for women with endocrine responsIVE breast cancer: Primary Results from the POSITIVE Trial (IBCSG 48-14/BIG 8-13) // Cancer Research. 2023. Vol. 83. P. GS4–09. https://doi.org/10.1158/1538-7445. SABCS22-GS4-09.
15. Shao C., Yu Z., Xiao J. et al. Prognosis of pregnancy-associated breast cancer: A meta-analysis // BMC Cancer. 2020. Vol. 20. https://doi.org/10.1186/s12885-020-07248-8.
Об авторах
Л. Д. БелоцерковцеваРоссия
доктор медицинских наук, профессор, заслуженный врач РФ, заведующая кафедрой акушерства, гинекологии и перинатологии, президент
Н. В. Климова
Россия
доктор медицинских наук, профессор, заведующая кафедрой многопрофильной клинической подготовки; заведующая рентгенологическим отделением
А. А. Кузнецов
Россия
кандидат медицинских наук, старший преподаватель, врач-рентгенолог
Рецензия
Для цитирования:
Белоцерковцева Л.Д., Климова Н.В., Кузнецов А.А. ДИАГНОСТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, АССОЦИИРОВАННОГО С БЕРЕМЕННОСТЬЮ. Вестник СурГУ. Медицина. 2025;18(2):65-72. https://doi.org/10.35266/2949-3447-2025-2-9
For citation:
Belotserkovtseva L.D., Klimova N.V., Kuznetsov A.A. PREGNANCY ASSOCIATED BREAST CANCER DIAGNOSTICS. Vestnik SurGU. Meditsina. 2025;18(2):65-72. (In Russ.) https://doi.org/10.35266/2949-3447-2025-2-9
JATS XML




















