Перейти к:
ОПТИМИЗАЦИЯ ПРОГНОЗА ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОК С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
https://doi.org/10.35266/2949-3447-2025-2-7
Аннотация
Рак молочной железы остается одним из распространенных заболеваний среди женского населения. При выявлении заболевания на ранней стадии хирургический метод является основным методом циторедукции, обеспечивающим наибольший успех в достижении высоких цифр отдаленной безрецидивной и общей выживаемости. Однако хирургические осложнения по-прежнему являются актуальной проблемой. Выполнение органосохраняющих операций с биопсией сигнального лимфатического узла в послеоперационном периоде может привести к развитию гематомы, серомы, инфекции, некроза лоскута. Разработанный нами способ резекции молочной железы с лимфодиссекцией позволил значительно снизить ранние послеоперационные осложнения на 3,8 % (против 27,6 % при классическом доступе, p < 0,05). При этом воспалительный инфильтрат в области послеоперационной раны наблюдался у 1,9 % пациенток (против 11,4 % при классическом доступе, p < 0,05), серома в области послеоперационной раны – у 1,9 % пациенток (против 14,2 % при классическом доступе, p < 0,05). Предложенный нами метод прогнозирования ранних послеоперационных осложнений был успешно апробирован и показал прогностическую значимость. Основным предиктором наступления раневых осложнений был показатель микроциркуляции. Термометрия же была дополнительным методом. Таким образом, применение Z‑образного доступа для органосохраняющего вмешательства при раке молочной железы, а также использование скрининговых методик является важным для оптимизации прогноза ранних хирургических осложнений.
Для цитирования:
Столяров С.А., Трусова Л.А. ОПТИМИЗАЦИЯ ПРОГНОЗА ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОК С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ. Вестник СурГУ. Медицина. 2025;18(2):52-59. https://doi.org/10.35266/2949-3447-2025-2-7
For citation:
Stolyarov S.A., Trusova L.A. POSTOPERATIVE COMPLICATIONS PROGNOSIS OPTIMIZATION IN PATIENTS WITH BREAST CANCER. Vestnik SurGU. Meditsina. 2025;18(2):52-59. (In Russ.) https://doi.org/10.35266/2949-3447-2025-2-7
ВВЕДЕНИЕ
Рак молочной железы (РМЖ) – одна из «молодеющих» опухолей, которая все чаще встречается у женщин детородного возраста и имеет самый высокий уровень заболеваемости и смертности среди всех злокачественных опухолей в женской когорте населения [1]. При выявлении заболевания на ранних стадиях хирургический метод циторедукции является приоритетным. В современное время на ранних стадиях успешно применяются органосохраняющие вмешательства с хорошим косметическим результатом и минимальной хирургической травмой.
Вместе с этим до сих пор не решен вопрос профилактики ранних послеоперационных раневых осложнений [2]. Развитие послеоперационных осложнений, в свою очередь, приводит к отсрочке адъювантного лечения, длительному периоду восстановления и увеличению нахождения пациента в стационаре, ухудшению психологического и физического здоровья.
По этой причине мониторинг послеоперационного периода, прогнозирование развития осложнений является актуальным.
Одним из объективных методов контроля состояния раны является ультразвуковое исследование [3]. Минусом данного метода является констатация появившихся проблем без ее прогнозирования. Необходимы достоверные предикторы, позволяющие спрогнозировать осложнение на раннем сроке и своевременно начать активные профилактирующие действия.
Учеными выполнялись поиски других возможных методов наблюдения за течением заживления раны (высокочастотная доплеровская ультрасонография, термография, реовазография, радиотермометрия, электромиография, лазерная доплеровская флоуметрия) [3–5].
Группа ученых, занимающихся лечением ожоговых ран, выяснила, что те участки кожи, которые на тепловизоре были отображены как «холодные», заживали дольше и хуже, чем другие участки раны [6–8].
Термометрия также успешно применялась у пациентов с лечением вентральных грыж [9]. Группой ученых было выявлено также, что показатель микроциркуляции коррелирует с скоростью и качеством регенерации раны [9–11].
Однако у пациенток с РМЖ на ранних стадиях при выполнении радикального варианта лечения подобные методы диагностики не применялись. В ходе нашего исследования был разработан и апробирован способ прогнозирования развития послеоперационных осложнений на основе локальной термометрии и оценки микроциркуляции у пациенток с РМЖ на ранних стадиях.
В ходе исследования проводилась сравнительная оценка показателей термометрии, микроциркуляции, объективных клинических данных у пациентов, которым выполнена операция из стандартного линейного и предложенного нами Z-образного доступа.
Цель – оптимизация прогноза послеоперационных осложнений у пациенток с раком молочной железы.
МАТЕРИАЛЫ И МЕТОДЫ
Данное исследование является одноцентровым, сравнительным, ретроспективным. В него вошло 210 пациентов, госпитализированных в отделение опухолей молочной железы № 1 за период с сентября 2020 по февраль 2023 г.
Критериями включения являлись: верифицированный диагноз РМЖ от 0-й до IB стадий, возможность проведения органосохранной операции (BRCA 1-, BRCA 2-отрицательный статус), отсутствие декомпенсации по сопутствующим соматическим заболеваниям. Отрицательный результат срочного гистологического исследования биоптата секторальной резекции молочной железы с исследованием краев в области инфрамаммарной складки (данный тест верифицирует адекватный объем вмешательства, если же результат положительный, объем операции расширяется, что является критерием выхода из исследования). Информированное добровольное участие в исследовании.
Критериями исключения являлись: наличие у пациентов РМЖ IIA–IV стадий, первично-множественные опухоли, декомпенсация по сопутствующим соматическим заболеваниям, инъекционная наркомания.
Все пациентки были разделены методом рандомизации на основную и контрольную группы по объему выполненного лечения:
Группа исследования – 105 пациентов, которым проведено хирургическое лечение в объеме радикальной резекции молочной железы с применением разработанного доступа (рис. 1).
Первым этапом двумя эллипсоидными разрезами была рассечена кожа пораженной молочной железы до фасции большой грудной мышцы. Иссекали ткань молочной железы с опухолевым узлом. Вторым этапом разрез кожи длиной 6 см продлевался к аксиллярной области по краю большой грудной мышцы (отметка 2 в рис. 1), опускается к задней поверхности подмышечной ямки под углом 45 градусов на протяжении 3 см (отметка 3 в рис. 1), а затем направляется к краю широчайшей мышцы спины (отметка 4 в рис. 1). Кожа и подкожная клетчатка отсепаровываются и отводятся кверху (отметка 5 в рис. 1). В ходе операции осуществляется изоляция вены axillaris, за которой следует диссекция жировой ткани с помощью тупфера до выявления поверхностных вен, включая латеральную грудную и торакоэпигастральную вены. Для обеспечения полной видимости всех анатомических структур подмышечной впадины устанавливается ретрактор под малую грудную мышцу и проводится растяжение тканей у латерального края разреза. Поверхностные вены подвергаются перевязке и пересечению. Межреберно-плечевые нервы остаются нетронутыми, чтобы сохранить чувствительную иннервацию медиальной части плеча. Лимфаденодиссекция начинается с экстирпации лимфатических узлов, находящихся под малой грудной мышцей. Важно сохранить сосудисто-нервный пучок, входящий в большую грудную мышцу с латеральной стороны, чтобы предотвратить атрофию мышцы. Отделение жировой ткани производится тупым способом с использованием тупфера. По завершении диссекции жировой клетчатки и железистой ткани производилась лимфодиссекция. Устанавливалась дренажная трубка, рана ушивалась послойно узловыми швами.
- Контрольная группа – 105 пациентов, которым было выполнено лечение согласно клиническим рекомендациям для больных с диагнозом РМЖ 0–IB ст. Пациенты контрольной группы были оперированы в объеме радикальной резекции молочной железы и биопсии сигнального лимфатического узла из линейного доступа. Объем операции был тот же.
Формирование групп пациентов для проведения исследования осуществлялось методом простого рандомизированного отбора – простая случайная выборка.
Пациенты в группах сравнения были сопоставимы по возрасту, полу, сопутствующим заболеваниям, стадии основного заболевания и молекулярно-биологическому типу опухоли.
Молекулярные подтипы РМЖ определялись в соответствии с классификацией по клиническим рекомендациям «Рак молочной железы» Министерства здравоохранения России 2018 г. [12].
Перед госпитализацией в стационар, пациенты, включенные в исследование, проходили стандартный амбулаторный комплекс обследований.
Инструментальные методы. Метод прогнозирования раневых осложнений был основан на оценке результатов локальной термометрии и микроциркуляции в области раны в раннем послеоперационном периоде.
Для диагностики микроциркуляции проводилось исследование с использованием комплекса «ЛАКК-М» (рис. 2).
Результаты оценивали в соответствии с валидированными референсными значениями и их клинической характеристикой (табл. 1).
Термометрию в области операционной раны проводили с использованием аппаратно-программного комплекса CG320 в сочетании с программой «ИК МЕД» (рис. 3).
В послеоперационном периоде оценка болевого синдрома проводилась на основе жалоб пациенток, а также с использованием вербальной шкалы (ШВО) и опросника интенсивности боли (итоговый результат оценки боли высчитывался как среднее арифметическое результатов двух вышеупомянутых тестов).
Статистический анализ данных проводился с использованием пакета программ Microsoft Excel. Данные аккумулировались в виде сводной таблицы, после чего проводилась статистическая обработка в пакете программ SPSS.
Проверка параметра на нормальное распределение осуществлялась с применением критерия Колмогорова – Смирнова. Большинство данных имело распределение отличное от нормального, в связи с чем в дальнейшем использовались непараметрические критерии статистики. Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна – Уитни. Для проверки различий между двумя сравниваемыми парными выборками нами применялся W-критерий Уилкоксона.
Для оценки диагностической значимости оценки термометрии и микроциркуляции для прогнозирования ранних раневых осложнений применялся анализ ROC-кривых, результат которого был представлен как площадь под кривой (AUC), уровень статистической значимости (p) и 95 % доверительные интервалы (ДИ). Оптимальная точка отсечения определялась по наибольшему индексу Юдена, для нее оценивали индексы чувствительности (Se) и специфичности (Sp).
Исследование одобрено этическим комитетом ЧУ ОО ВО «Медицинский университет “Реавиз”», не имеет конфликта интересов и не противоречит действующим клиническим рекомендациям.

Рис. 1. Способ органосохраняющей операции при РМЖ с локализацией опухоли в верхнем наружном квадранте:
1 – опухоль молочной железы;
2 – первая линия разреза;
3 – вторая линия разреза;
4 – третья линия разреза;
5 – отведение кожно-подкожного слоя;
6 – сосудисто-нервный пучок подмышечной ямки
Примечание: составлено авторами.

Рис. 2. Лазерный анализатор «ЛАКК-М»
Примечание: составлено авторами.
Таблица 1
Состояние раны и показатели микроциркуляции в месте операции
Интервалы значений ПМ, перф. ед. | Состояние раны |
17,5–27,1 | Раневые осложнения отсутствовали, фазы раневого процесса протекали гладко |
8,5–17,4 | Наблюдались повышенные воспалительные явления в ране в виде более выраженного и стойкого отека, однако эпителизация укладывалась в сроки нормального заживления раны |
7,0–8,4 | Сроки заживления раны затягивались. Наблюдалось увеличение срока госпитализации пациента |
< 6,9 | Наблюдалось скопление экссудата в месте выполнения лимфодиссекции, сроки госпитализации превышали двойное стандартное отклонение, рассчитанное для исследуемой группы |
Примечание: составлено авторами.
Рис. 3. Тепловизионный аппаратно-программный комплекс «ТЦР-Мед»
Примечание: составлено авторами.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В исследуемых группах сравнения было выявлено, что возраст пациентов на момент установки диагноза варьировал от 23 до 72 лет (медиана 40 лет [ 31,6; 64,2]). Пациенты обеих групп были распределены по стадиям основного заболевания согласно классификации злокачественных опухолей TNM (TNM Classification of Malignant Tumours, 8th edition, Wiley-Blackwell, 2017). Распределение пациенток в зависимости от основного заболевания представлено в табл. 2.
Пациенты основной и контрольной групп были сопоставимы по стадиям основного заболевания, что исключает гетерогенность групп и позволяет оценить послеоперационные результаты в условиях «чистого эксперимента».
При анализе сопутствующих заболеваний нами было выявлено, что в основной группе преобладала гипертоническая болезнь, и число пациенток с этим сопутствующим заболеванием составило 75 человек (71,4 %), тогда как в контрольной группе их было 77 человек (73,3 %). Язвенная болезнь желудка, не находящаяся в стадии обострения, была у 1 человека в каждой группе. Сахарный диабет II типа был диагностирован у 22 пациенток (20,9 %) основной и у 23 пациенток (21,9 %) контрольной группы. Гепатит С выявили у 15 пациенток (14,2 %) основной и у 14 пациенток (13,3 %) контрольной группы. Подробное распределение пациенток в группах сравнения представлено в табл. 3.
При изучении группы исследования было выявлено, что у пациентов наблюдалось одновременно несколько сопутствующих заболеваний без статистически значимых различий (p > 0,05).
Всем пациентам, которые были включены в исследование, выполнялось иммуногистохимическое исследование (ИГХ) для определения рецепторного статуса заболевания (ER, PR, HER2, Ki-67). Исследование показало следующее распределение подтипов РМЖ среди участниц: люминальный A подтип встречался у 44 женщин (21 %), люминальный B (HER-2-позитивный) был обнаружен у 43 (20 %), люминальный B (HER-2-негативный) – у 43 (20 %) пациенток, а тройной негативный рак – у 38 (18 %) пациенток. Молекулярные подтипы опухоли у пациентов, которые были включены в исследование, отображены в табл. 4.
Пациенты основной и контрольной групп были сопоставимы по молекулярному подтипу опухоли уровня значимости (p > 0,05). С целью сравнения течения раневого процесса после оперативного лечения пациенток с диагнозом «РМЖ» применялся способ прогнозирования развития раневых осложнений.
Интраоперационные данные. При анализе интраоперационной кровопотери в группах сравнения было установлено, что у пациентов контрольной группы средний объем кровопотери составил 52,32 ± 12,2 мл, в то время как у пациентов основной группы он составил 41,43 ± 11,4 мл. Среднее снижение кровопотери при втором типе операции составило 22,92 %, что было статистически значимым (p < 0,05).
Течение раннего послеоперационного периода
Болевой синдром. При анализе болевого синдрома в группах исследования было установлено, что у пациентов контрольной группы наблюдался значительный болевой синдром на 10-й день после операции. Количество пациентов с интенсивностью боли 3 составило 30 (28,5 %) человек. При оценке показателей на день выписки было обнаружено, что у пациенток контрольной группы с интенсивностью боли, равной 4, было 5 человек (4,7 %), с интенсивностью боли 3–27 человек (25,7 %). В то же время у пациенток основной группы интенсивность боли 4 составила 3 человека (2,8 %), а с болевым синдромом 3 по шкале ШВО – 14 человек (13,3 %) (p < 0,05).
В целом менее выраженный болевой синдром в группе исследования объективизировался не только статистически значимо более низкими баллами тестов, но и меньшей потребностью в анальгезии.
Раневые осложнения. После хирургического вмешательства оценивали ранние (до 8 суток после операции) осложнения. В контрольной группе на вторые сутки послеоперационного периода была выявлена подкожная гематома в месте операции размерами 1,5 × 1,5 см и 2,0 × 1,0 см. У 12 пациенток контрольной группы в послеоперационном периоде наблюдался воспалительный инфильтрат, который отмечался в аксиллярной области. В 1 случае у пациентки контрольной группы наблюдался инфильтрат размерами более 4 см, разрешение которого протекало медленно, несмотря на антибактериальную терапию и местное лечение. Послеоперационные осложнения, которые наблюдались в группах исследования, отображены в табл. 5.
Основными осложнениями были воспалительный инфильтрат в области послеоперационной раны и серома мягких тканей в области операционной раны.
Во время ежедневного мониторинга показателей локальной микроциркуляции и термометрии нами было установлено, что показатель микроциркуляции в контрольной группе увеличивался начиная с 3-х суток госпитализации на 2,1 ± 1,5 перф. ед.; клинически в показатели микроциркуляции и термометрии в сравниваемых группах представлены в табл. 6.
Был проведен ROC-анализ для определения диагностической значимости предикторов данных осложнений. Был выявлен всего один статистически значимый фактор – уровень микроциркуляции. При определении диагностической значимости уровня микроциркуляции при прогнозировании воспалительного инфильтрата получены следующие результаты: AUC = 0,673 с 95,0 % ДИ 0,507–0,710 (р = 0,03). При микроциркуляции менее 15 чувствительность к развитию воспалительного инфильтрата 35,7 %, специфичность – 92,9 % (рис. 4).
При определении диагностической значимости уровня микроциркуляции при прогнозировании развития серомы получены следующие результаты: AUC = 0,673 с 95,0 % ДИ 0,507–0,710 (р = 0,03). При микроциркуляции менее 15 чувствительность к развитию воспалительного инфильтрата 71,4 %, специфичность – 60,2 % (рис. 5).
К сожалению, ROC-анализ прогностической значимости термометрии не показал статистически значимых результатов из-за высокой вариабельности локальной температуры. Однако мы считаем, что данный метод также важен для прогнозирования послеоперационных осложнений и может дополнять остальные скрининговые методики.
Данные, полученные в ходе исследования, послужили основой для создания методики прогнозирования раневых осложнений на основе измерения микроциркуляции и локальной температуры в месте проведения операции. Данная методика защищена патентом № 2790464, зарегистрированным 21 февраля 2023 г.
Таблица 2
Стадия заболевания в группах исследования
Стадия по TNM | Основная группа (n = 105) | Контрольная группа (n = 105) | p-value | ||
АБС | % | АБС | 100 % | ||
Стадия 0 (TisN0M0) | 5 | 4,8 % | 7 | 6,8 % | p > 0,05 |
Стадия I А (pT1N0M0) | 40 | 38,1 % | 36 | 34,3 % | p > 0,05 |
Стадия I B (T0N1miM0) | 27 | 25,7 % | 30 | 28,5 % | p > 0,05 |
Стадия I B (T1N1miM0) | 33 | 31,4 % | 32 | 30,5 % | p > 0,05 |
Всего | 105 | 100 % | 105 | 100 % | - |
Примечание: составлено авторами.
Таблица 3
Распределение сопутствующих заболеваний в группах исследования
Сопутствующее заболевание | Основная группа (n = 105) | Контрольная группа (n = 105) | p-value | ||
Частота | % | Частота | % | ||
Гипертоническая болезнь | 75 | 71,4 | 77 | 73,3 | p > 0,05 |
Язвенная болезнь желудка, вне обострения | 1 | 0,95 | 1 | 0,95 | p > 0,05 |
Сахарный диабет 2-й ст. | 22 | 20,9 | 23 | 21,9 | p > 0,05 |
Варикозная болезнь вен н/конечностей | 44 | 41,9 | 42 | 40 | p > 0,05 |
Облитерирующий атеросклероз аорты | 22 | 20,9 | 22 | 20,9 | p > 0,05 |
Ожирение 1-й ст. | 25 | 23,8 | 25 | 23,8 | p > 0,05 |
Ожирение 2-й ст. | 13 | 12,5 | 14 | 13,3 | p > 0,05 |
HCV | 15 | 14,2 | 14 | 13,3 | p > 0,05 |
Грыжа пищеводного отверстия диафрагмы | 26 | 24,7 | 25 | 23,8 | p > 0,05 |
Примечание: составлено авторами.
Таблица 4
Частота молекулярно-биологических подтипов опухолей в выборках пациентов
Молекулярный подтип опухоли | Основная группа (n = 105) | Контрольная группа (n = 105) | p-value | ||
Частота | % | Частота | % | p > 0,05 | |
Люминальный А | 23 | 22 | 21 | 20 | p > 0,05 |
Люминальный В, HER2-отрицательный | 22 | 21 | 21 | 20 | p > 0,05 |
Люминальный В, HER2-положительный | 21 | 20 | 22 | 21 | p > 0,05 |
Тройной негативный фенотип | 19 | 18 | 19 | 18 | p > 0,05 |
HER2-положительный, Не люминальный (HER2+) | 20 | 19 | 22 | 21 | p > 0,05 |
Примечание: составлено авторами.
Таблица 5
Послеоперационные осложнения в группах исследования
Осложнения | Контрольная группа n (%) | Основная группа n (%) | p-value |
Гематома операционной раны | 2 (1,9) | 0 (0,00) | > 0,05 |
Воспалительный инфильтрат в области послеоперационной раны | 12 (11,4) | 2 (1,9) | < 0,05 |
Серома мягких тканей в области операционной раны | 15 (14,2) | 2 (1,9) | < 0,05 |
Всего | 29 (27,6) | 4 (3,8) | < 0,05 |
Примечание: составлено авторами.
Таблица 6
Соотношение микроциркуляции и локальной термометрии в группах исследования
Показатели | Контрольная группа (n = 105) | Основная группа (n = 105) | Уровень значимости различий (р) |
Воспалительный инфильтрат в месте операции | |||
Встречаемость, чел. (%) | 12 (11,4) | 2 (1,9) | 0,00001 |
Локальная температура, °С | 37,6 + –38,1 | 37,9 + –39,1 | 0,00001 |
Микроциркуляция (перф. ед) | 31,1 [ 29; 39.1] | 21.2 [ 18,5;28,9] | 0,0010 |
Серома мягких тканей в области операционной раны | |||
Встречаемость, чел. (%) | 15 (14,2) | 2 (1,9) | 0,00001 |
Локальная температура °С0 | 37,6 + –38,1 | 37,9 + –39,1 | 0,0010 |
Микроциркуляция (перф. ед.) | 32,1 [ 28; 39.1] | 21,2 [ 18,5;28,9] | 0,0010 |
Примечание: составлено авторами.
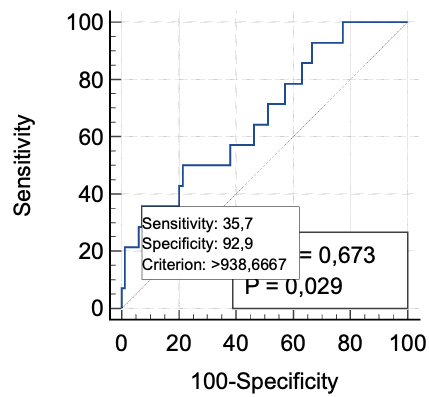
Рис. 4. ROC-кривая, описывающая взаимосвязь встречаемости инфильтрата с уровнем микроциркуляции
Примечание: составлено авторами.
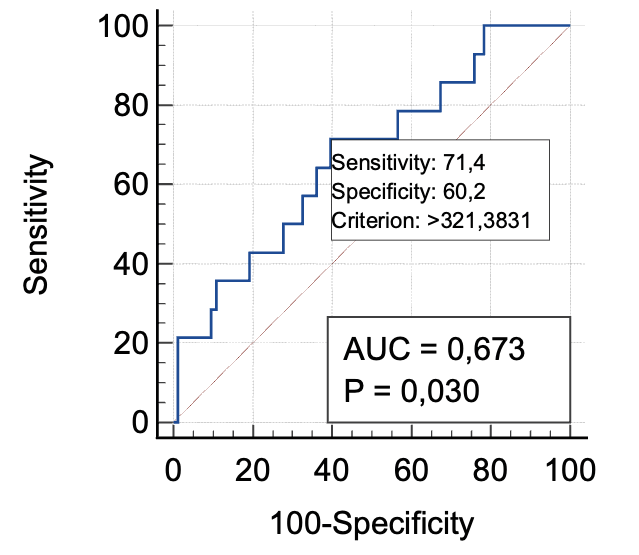
Рис. 5. ROC-кривая, описывающая взаимосвязь встречаемости раневых сером с уровнем микроциркуляции.
Примечание: составлено авторами.
ЗАКЛЮЧЕНИЕ
Разработанный нами способ резекции молочной железы с лимфодиссекцией позволил значительно снизить ранние послеоперационные осложнения на 3,8 % (против 27,6 % при классическом доступе, p < 0,05). При этом воспалительный инфильтрат в области послеоперационной раны наблюдался у 1,9 % пациенток (против 11,4 % при классическом доступе, p < 0,05), серома в области послеоперационной раны – у 1,9 % пациенток (против 14,2 % при классическом доступе, p < 0,05).
Предложенный нами метод прогнозирования ранних послеоперационных осложнений был успешно апробирован и показал прогностическую значимость. Основным предиктором наступления раневых осложнений был показатель микроциркуляции. Термометрия же была дополнительным методом.
При определении диагностической значимости уровня микроциркуляции при прогнозировании воспалительного инфильтрата получены следующие результаты: AUC = 0,673 с 95,0 % ДИ 0,507–0,710 (р = 0,03). При микроциркуляции менее 15 чувствительность к развитию воспалительного инфильтрата 35,7 %, специфичность – 92,9 %.
При определении диагностической значимости уровня микроциркуляции при прогнозировании развития серомы получены следующие результаты: AUC = 0,673 с 95,0 % ДИ 0,507–0,710 (р = 0,03). При микроциркуляции менее 15 чувствительность к развитию воспалительного инфильтрата 71,4 %, специфичность – 60,2 %.
Таким образом, применение Z-образного доступа для органосохраняющего вмешательства при РМЖ, а также использование скрининговых методик является важным для оптимизации прогноза ранних хирургических осложнений.
Список литературы
1. Sung H., Ferlay J., Siegel R. L. et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA: A Cancer Journal for Clinicians. 2021. Vol. 71, no. 3. P. 209–249. https://doi.org/10.3322/caac.21660.
2. Lohani K. R., Kumar C., Kataria K. et al. Role of tranexamic acid in axillary lymph node dissection in breast cancer patients // The Breast Journal. 2020. Vol. 26, no. 7. P. 1316–1320. https://doi.org/10.1111/tbj.13810.
3. Ma H., Ursin G., Xu X. et al. Body mass index at age 18 years and recent body mass index in relation to risk of breast cancer overall and ER/PR/HER2-defined subtypes in white women and African-American women: A pooled analysis // Breast Cancer Research. 2018. Vol. 20. https://doi.org/10.1186/s13058-017-0931-5.
4. Krug E., Berg L., Lee C. et al. Evidence-based recommendations for the use of negative pressure wound therapy in traumatic wounds and reconstructive surgery: Steps towards an International Consensus // Injury. 2021. Vol. 42. P. 1–12. https://doi.org/10.1016/S0020-1383(11)00041-6.
5. Nischwitz S. P., Luze H., Kamolz L.-P. Thermal imaging via FLIR One – A promising tool in clinical burn care and research // Burns. 2020. Vol. 46, no. 4. P. 988–989. https://doi.org/10.1016/j.burns.2020.02.017.
6. Wearn C., Lee K. C., Hardwicke J. et al. Prospective comparative evaluation study of laser Doppler imaging and thermal imaging in the assessment of burn depth // Burns. 2018. Vol. 44, no. 1. P. 124–133. https://doi.org/10.1016/j.burns.2017.08.004.
7. Hardwicke J., Thomson R., Bamford A. et al. A pilot evaluation study of high resolution digital thermal imaging in the assessment of burn depth // Burns. 2013. Vol. 39, no. 1. P. 76–81. https://doi.org/10.1016/j.burns.2012.03.014.
8. Jaspers M. E. H., Maltha I., Klaessens J. H. G. M. et al. Insights into the use of thermography to assess burn wound healing potential: A reliable and valid technique when compared to laser Doppler imaging // Journal of Biomedical Optics. 2016. Vol. 21, no. 9. https://doi.org/10.1117/1.jbo.21.9.096006.
9. Lightner A. L., Fleshner P. R. Introducing the management of postoperative complications // Surgical Clinics of North America. 2021. Vol. 101, no. 5. P. xvii–xviii. https://doi.org/10.1016/j.suc.2021.07.002.
10. Федорович А. А. Микрососудистое русло кожи человека как объект исследования // Регионарное кровообращение и микроциркуляция. 2017. Т. 16, № 4. С. 11–26. https://doi.org/10.24884/1682-6655-2017-16- 4-11-26.
11. Secomb T. W., Pries A. R. The microcirculation: Physiology at the mesoscale // The Journal of Physiology. 2011. Vol. 589, no. 5. P. 1047–1052. https://doi.org/10.1113/jphysiol.2010.201541.
12. Рак молочной железы : клинические рекомендации. 2018. URL: https://oncology.ru/association/clinical-guidelines/2018/rak_molochnoy_zhelezy_pr2018.pdf (дата обращения: 05.04.2025).
Об авторах
С. А. СтоляровРоссия
доктор медицинских наук, профессор, заведующий кафедрой хирургических болезней
Л. А. Трусова
Россия
ассистент, врач – онколог-хирург
Рецензия
Для цитирования:
Столяров С.А., Трусова Л.А. ОПТИМИЗАЦИЯ ПРОГНОЗА ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ У ПАЦИЕНТОК С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ. Вестник СурГУ. Медицина. 2025;18(2):52-59. https://doi.org/10.35266/2949-3447-2025-2-7
For citation:
Stolyarov S.A., Trusova L.A. POSTOPERATIVE COMPLICATIONS PROGNOSIS OPTIMIZATION IN PATIENTS WITH BREAST CANCER. Vestnik SurGU. Meditsina. 2025;18(2):52-59. (In Russ.) https://doi.org/10.35266/2949-3447-2025-2-7
JATS XML




















