Перейти к:
КЛИНИЧEСКИЙ СЛУЧАЙ ОТДАЛЕННЫХ СEПТИЧEСКИХ ОСЛОЖНEНИЙ ПОСЛEРОДОВОГО ПEРИОДА ПОСЛE ПEРEНEСЕННОЙ ТЯЖЕЛОЙ ПРEЭКЛАМПСИИ, АКУШEРСКОГО КРОВОТEЧEНИЯ С ЭМБОЛИЗАЦИEЙ МАТОЧНЫХ АРТEРИЙ У ПАЦИEНТКИ С КОМОРБИДНОЙ ПАТОЛОГИEЙ
https://doi.org/10.35266/2949-3447-2025-1-8
Аннотация
Акушерские кровотечения, гипертензивные нарушения, септические осложнения до настоящего времени занимают лидирующие позиции среди причин материнской заболеваемости и смертности. При этом одно заболевание может вносить потенциальный вклад в развитие другого осложнения. Так, эндоваскулярная эмболизация маточных артерий, эффективный современный метод лечения послеродового кровотечения, в сочетании с другими факторами, в том числе сопутствующей коморбидной соматической патологией, может способствовать развитию асептического воспаления – некрозу матки и потенциально угрожать здоровью и жизни женщины. Анализ клинического случая едва не умершей пациентки («near miss») с коморбидной акушерской и соматической патологией после перенесенного акушерского кровотечения и эмболизации маточных артерий позволил разобрать возможные причины развития некроза матки и показал сложность его диагностики.
Ключевые слова
Для цитирования:
Козина Ю.Ю., Каспарова А.Э., Маннапова Ю.Ф., Васильковская Е.Н., Некрасова Л.Ф. КЛИНИЧEСКИЙ СЛУЧАЙ ОТДАЛЕННЫХ СEПТИЧEСКИХ ОСЛОЖНEНИЙ ПОСЛEРОДОВОГО ПEРИОДА ПОСЛE ПEРEНEСЕННОЙ ТЯЖЕЛОЙ ПРEЭКЛАМПСИИ, АКУШEРСКОГО КРОВОТEЧEНИЯ С ЭМБОЛИЗАЦИEЙ МАТОЧНЫХ АРТEРИЙ У ПАЦИEНТКИ С КОМОРБИДНОЙ ПАТОЛОГИEЙ. Вестник СурГУ. Медицина. 2025;18(1):67-72. https://doi.org/10.35266/2949-3447-2025-1-8
For citation:
Kozina Yu.Yu., Kasparova A.E., Mannapova Yu.F., Vasilkovskaya E.N., Nekrasova L.F. CLINICAL CASE OF DELAYED SEPTIC COMPLICATIONS DURING POSTPARTUM AFTER SEVERE PREECLAMPSIA, OBSTETRIC HEMORRHAGE WITH UTERINE ARTERY EMBOLIZATION IN PATIENT WITH COMORBID PATHOLOGY. Vestnik SurGU. Meditsina. 2025;18(1):67-72. (In Russ.) https://doi.org/10.35266/2949-3447-2025-1-8
ВВЕДЕНИЕ
Материнская смертность (МС) – важнейший показатель здоровья женщин репродуктивного возраста в мире. Уровень МС является одним из основных критериев развития общества, уровня и качества здравоохранения каждой страны, эффективности внедрения научных достижений. По причине осложнений беременности и родов ежегодно в мире умирает более 300 000 женщин [1][2]. Акушерские кровотечения, гипертензивные нарушения, включая преэклампсию и эклампсию, занимают лидирующие позиции среди причин МС. К сожалению, часто не учитывается, что одно заболевание вносит потенциально важный вклад в развитие других осложнений и их негативное потенциальное взаимодействие приводит к развитию неблагоприятных перинатальных исходов. Септические осложнения в акушерско-гинекологической практике стабильно входят в пятерку структуры причин МС в мире, что связано с различными социально-экономическими и медицинскими факторами.
Согласно данным ВОЗ, почти 95 % всех случаев МС в 2020 г. произошли в странах с низким и ниже среднего уровнем дохода, и в большинстве случаев могли быть предотвращены (результаты Глобального исследования материнского сепсиса (GLOSS), 2020). Но увеличение частоты послеродовых инфекций, их осложнений и смертей по причине послеродовых септических осложнений, регистрируется не только в странах с низким уровнем дохода, но и в развитых странах, что объясняется многими факторами риска, в том числе завершением эры антибиотиков и развитием антибиотикорезистентности [3], ростом абдоминального родоразрешения, а также современными методами и возможностями остановки послеродовых кровотечений без проведения органоуносящих операций.
Эмболизация маточных артерий (ЭМА) является эффективным гемостатическим методом лечения послеродового кровотечения (ПРК), регламентированным клиническими рекомендациями «Послеродовое кровотечение» (2021). Интерес к исходам ЭМА как этапу остановки кровотечения в послеродовом периоде возрос в странах с высоким уровнем дохода. В России данный метод остановки послеродового кровотечения используется с 2006 г. [1]. В окружной клинической больнице города Ханты-Мансийска данная операция была внедрена с 2010 г. Одновременно с оценкой эффективности используемой технологии всегда поднимается вопрос о безопасности эндоваскулярного вмешательства.
Основные осложнения ЭМА можно разделить на три категории.
- Травматические (надрыв или разрыв сосудов, аневризма места пункции и тромбоз атриовентрикулярного клапана).
- Септические (ишемия или некроз матки, влагалища, мочевого пузыря или дистальных отделов конечностей).
- Инфекционные (инфекция в месте пункции, воспалительная болезнь матки, пиометра, абсцесс и сепсис) [4].
Некроз матки – редкое и опасное для жизни осложнение при проведении ЭМА при послеродовом кровотечении. При этом проведение хирургического лечения, которое включает резекцию некротической ткани матки с восстановлением мышечной стенки не всегда технически возможно и эффективно. В итоге в большинстве случаев пациенткам приходится делать гистерэктомию. Из основных законов патологической физиологии известно, что если ишемизации подвергается «стерильная» ткань, то развивается так называемый коагуляционный вариант некроза. Если же ткань содержит микроорганизмы, то в результате ишемии развивается колликвационный некроз [5]. Сам механизм ЭМА рассчитан на развитие коагуляционного некроза и сохранение детородного органа, в то время как колликвационный некроз перечеркивает весь смысл такого метода лечения. В целом текущая научная литература подтверждает, что несколько факторов могут способствовать некрозу матки, включая строгие показания и противопоказания к данной операции, природу и размер эмболизирующего агента [6]. Постоянные эмболизационные материалы, такие как металлические микроспирали и микрочастицы поливинилалкоголя (ПВА), имеют больше шансов вызвать осложнение в виде массивного некроза. С целью гемостаза при акушерских кровотечениях чаще применяют желатиновые губки в виде пломбировочного материала или суспензии [4][6][7].
Существует ряд причин развития некроза матки, в том числе растяжение матки после родов, позволяющее частицам достигать более отдаленные сосуды, а также использование чрезмерно мелких эмульгированных частиц, которые закупоривают дистальные сосуды, достигая коллатеральные сосуды, включая маточно-яичниковые и шеечно-влагалищные артерии. Отсутствие анастомоза между маточной и яичниковой артериями, по-видимому, увеличивает риск некроза матки, особенно если эмболизирующий агент не рассасывается со временем из-за чрезмерной эмболизации и спазмированных артерий. Эмболизация, проводимая под высоким давлением, потенциально перенаправляет эмболизат в дистальные анастомотические каналы, тем самым увеличивая риск нежелательной окклюзии [8].
Развитию некроза способствует также наличие коморбидной акушерской и соматической патологии. Так, при преэклампсии, характеризующейся гиповолемией, системной дисфункцией эндотелия, тромботическими нарушениями и повышенной проницаемости сосудов, происходит истощение внутрисосудистого объема крови, способствующее ишемии. Сахарный диабет (СД) с нарушением микроциркуляции, иннервации при присоединении инфекции часто осложняется развитием гнойно-некротических воспалительных заболеваний, а в сочетании с ишемизацией тканей при ЭМА происходит усугубление тяжести течения патологического процесса.
Во избежание ишемии миометрия в последние годы врачи все чаще отказываются от агрессивной техники, характеризующейся проведением эмболизации до полного стаза контраста в маточной артерии. С учетом недостаточного количества научных публикаций о качестве ЭМА как метода хирургического лечения у пациентов с коморбидной патологией был проведен литературный поиск материала и проанализирован клинический случай.
Цель – проведение анализа клинического случая едва не умершей женщины («near miss») с коморбидной акушерской и соматической патологией, обусловленной септическими осложнениями послеродового периода после перенесенного акушерского кровотечения и эмболизации маточных артерий.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен анализ публикаций в электронной базе научных данных: PubMed, eLIBRARY.RU, Academia, КиберЛенинка и др. с использованием ключевых слов: акушерские кровотечения, методы остановки кровотечений, эмболизация сосудов матки, септические осложнения. Глубина поиска составила 10 лет.
Учитывая сложный клинический случай молодой едва не умершей женщины, который включал в себя несколько критических акушерских состояний (тяжелая преэклампсия, послеродовое кровотечение с ЭМА, послеродовый гнойный панметрит, метротромбофлебит, ишемический некроз матки), нами проведен детальный разбор данного клинического наблюдения. Показаны сложности диагностики, связанные с поздней манифестацией симптомов септических осложнений, их атипичным течением на фоне тяжелого, длительно существующего сахарного диабета 1-го типа. У пациентки было получено письменное добровольное информированное согласие на оказание медицинской помощи.
Исследование выполнено в соответствии с принципами Хельсинкской декларации, одобрено комитетом по этике Ханты-Мансийской государственной медицинской академии.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Клиническое наблюдение
В 2016 г. пациентка Н., 25 лет, поступила в гинекологическое отделение на 30-е сутки послеродового периода после первых преждевременных оперативных родов в сроке 35–36 недель. Показанием для преждевременного родоразрешения была тяжелая преэклампсия. Интраоперационная кровопотеря после операции была умеренной (500 мл), однако через 6 часов на фоне динамического наблюдения началось раннее послеродовое кровотечение с объемом кровопотери 1200 мл. На фоне стабильной гемодинамики родильницы была проведена ЭМА, гемостатическая медикаментозная терапия (согласно протоколу), а также трансфузия свежезамороженной плазмы. Обращало на себя внимание, что при проведении эндоваскулярной ЭМА и введении в маточные артерии гомогенизированной гемостатической губки на контрольной ангиографии с обеих сторон был выявлен крупный дренирующий маточный сосуд с выраженным сбросом контрастного вещества в полость матки, повторное введение губки было безрезультатным, в связи с чем была выполнена эмболизация основного ствола маточной артерии с обеих сторон спиралью 4/3 с полной редукцией кровотока ветвей маточных артерий при контрольной ангиографии (рис. 1 а, б).
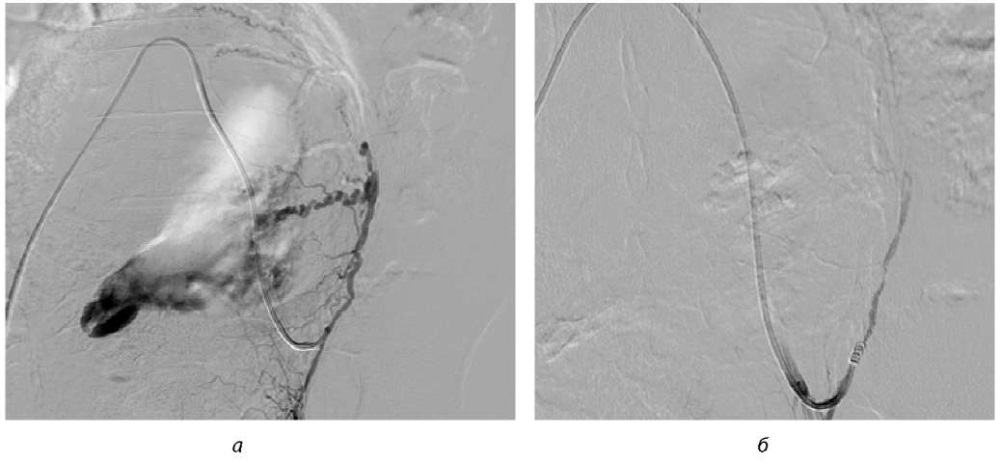
Рис. 1. Ангиография до и после эмболизации маточных артерий:
а) крупный дренирующий маточный сосуд с выраженным сбросом контрастного вещества в полость матки;
б) эмболизация основного ствола маточной артерии с обеих сторон спиралью 4/3 с полной редукцией кровотока ветвей маточных артерий
Примечание: рисунки авторов.
Из сопутствующей патологии родильница с 7 лет страдала тяжелым СД 1-го типа, целевой НвА1 с – менее 6,5 %, диабетической ангиоретинопатией обоих глаз, непролиферативной формой, диабетической полинейропатией верхних и нижних конечностей, сенсорной формой и диабетической нефропатией в стадии протеинурии, хронической почечной недостаточностью (ХПН) 0-й ст. (по Рябову), хронической болезнью почек (ХБП) 1 по K/DOQI. Во время беременности пациентка дважды санировала неспецифический вагинит, проходила лечение в отделении патологии беременности на сроке 32–33 недель по поводу плацентарных нарушений, многоводия, вызванных беременностью отеков и СД 1-го типа.
На 5-е сутки после родоразрешения пациентка была переведена в кардиологическое отделение по поводу тяжелой артериальной гипертензии, обусловленной тяжелой преэклампсией. Пациентке была подобрана гипотензивная терапия, и при стабильных артериальном давлении и гликемии, нормальной коагулограмме она была выписана на 14-е сутки послеродового периода домой с рекомендациями. Гипотензивную терапию после выписки не получала.
При поступлении в гинекологическое отделение окружной клинической больницы города Ханты-Мансийска пациентка Н. предъявляла жалобы на повышение температуры до фебрильных цифр в течение 3 дней, головную боль, кровянистые выделения из половых путей. При поступлении состояние средней степени тяжести, температура – 37,1 °C, АД – 129 и 91 мм рт. ст. Обращала на себя внимание тахикардия, которая не соответствовала уровню субфебрильной температуры – частота сердечных сокращений (ЧСС) 121 уд. в мин. При гинекологическом осмотре шейка матки сформирована, в наружном зеве сгусток, тело матки было увеличено до 14–15 недель, мягковатое по консистенции, безболезненное, в остальном особых изменений не обнаружено.
В лабораторных показателях была выявлена анемия легкой степени с гемоглобином 113 г/л, нормальный уровень лейкоцитов 8,2 × 10⁹, тромбоцитов 267 × 10⁹, повышение СРБ до 145 г/л, гликемия 15,12 ммоль/л, гиперфибриногенемия 6,8 г/л, остальные лабораторные показатели были без изменений. После дополнительного обследования критерии сепсиса, акушерского перитонита исключены.
По данным УЗИ малого таза при поступлении размеры матки – 123 × 80 × 135 мм, объем матки 607 см³. На границе миометрия и полости матки лоцировались множественные гиперэхогенные включения, дающие акустические тени (соответствующие пиогенным включениям и наличию газа в миометрии – УЗ-признаку некроза матки), которые специалистом УЗД ошибочно были приняты за эмболизат. Полость матки была неправильной формы, неравномерно расширена до 30–36 мм с анэхогенным содержимым с линейными гиперэхогенными структурами. Цервикальный канал был расширен до 20 мм, а также заполнен анэхогенным содержимым с линейными гиперэхогенными структурами. Область послеоперационного рубца визуализировалась на всем протяжении – не была изменена. Жидкость в малом тазу не определялась. Было сделано заключение о том, что имеются эхо-признаки субинволюции матки, гематометры после ЭМА.
Назначена комплексная терапия послеродового метроэндометрита, включающая инфузионную, эмпирическую антибактериальную терапию, утеротоники, профилактику тромбоэмболических осложнений низкомолекулярными гепаринами, санацию влагалища, препараты железа, инсулинотерапию, гипотензивную терапию. На фоне начатого лечения сохранялась фебрильная температура выше 38 °C, тахикардия больше 100 уд/мин, гипергликемия до 16–19,2 ммоль/л, не поддающаяся коррекции, повышение СРБ, гипефибриногенемия, повышение D-димера до 3,4 мг/л при отсутствии лейкоцитоза ((8,2–5,5) × 10⁹), отрицательном прокальцитониновом тесте и других критериев сепсиса. Бактериологическое исследование биологического материала из цервикального канала на 4-е сутки от забора материала показало, что имеется массивный рост неспецифической микрофлоры Escherichia coli 10/6 и Klebsiella spp. 10/5, с резистентностью к цефалоспоринам 2, 3 и 4-го поколения.
На 36-е сутки послеродового, послеоперационного периода при нормальной температуре произведена вакуум-аспирация содержимого полости матки без расширения цервикального канала: удалены «старые» сгустки, получен некротический детрит при полном отсутствии кровопотери. Матка после вакуум-аспирации в размерах не сократилась. Совместно с клиническим фармакологом проведена коррекция антибактериальной терапии. На следующий день при сохраняющейся температуре тела до фебрильных цифр проведено повторно УЗИ и МРТ малого таза. При эхографии получено заключение о признаках субинволюции матки с увеличением ее объема до 844 см³, не исключенном эмболизате в полости матки, пиометре, был заподозрен некроз матки. При магнитно-резонансной томографии органов малого таза с контрастированием было получено следующее заключение: структура матки неоднородная за счет инфильтративно-некротических изменений миометрии, полость матки не просматривалась, при контрастировании сосудов матки не отмечается наличие перфузии матки, визуализировались только приводящие сосуды (рис. 2 а–в).
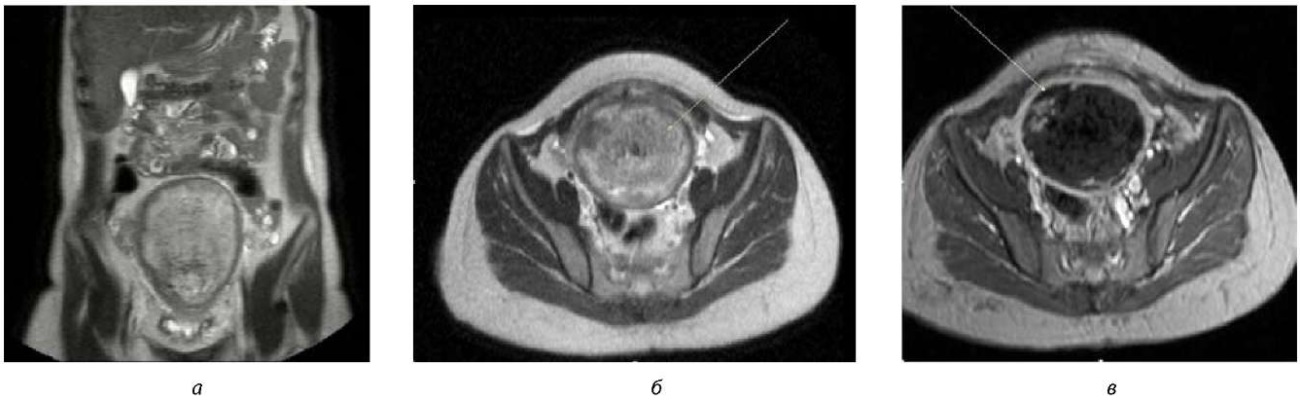
Рис. 2. Результаты магнитно-резонансной томографии органов малого таза с контрастированием в послеоперационном периоде:
а) МРТ матки без контрастного усиления (КУ), фронтальная проекция;
б) МРТ матки без КУ, аксиальная проекция;
в) МРТ матки после КУ, аксиальная проекция – некроз тканей. Структура матки неоднородная за счет инфильтративно-некротических изменений миометрии, полость матки не просматривается, при контрастировании сосудов матки не отмечается наличие перфузии матки
Примечание: рисунки авторов.
После проведенного дообследования на 37-е сутки послеродового периода консилиумом был выставлен диагноз: Послеродовый гнойный метрит, метротромбофлебит. Некроз матки. Принято решение об оперативном лечении в объеме релапаротомии, тотальной гистерэктомии с маточными трубами, по жизненным показаниям проведена коррекция антибактериальной терапии.
Во время операции выявлено: свободной жидкости в брюшной полости не было, тело матки увеличено до 16 нед., матка шаровидной формы, холодная на ощупь, неравномерной плотности и окраски, серозная оболочка тусклая, местами багрово-синюшная. По поверхности матки визуализировались извитые синюшно-багровые тромбированные сосуды диаметром от 3 до 6 мм. Маточные трубы внешне не изменены. Яичники нормальных размеров, с мелкими кровоизлияниями. В проекции сосудистых пучков пульсация сосудов не определялась, пальпировались плотные извитые тяжи.
Описание макропрепарата на разрезе: стенка матки отечная, толщиной до 4–5 см, губчатой структуры, 2/3 стенки матки серо-багрового цвета, остальная часть – субсерозно желтоватого цвета, в полости матки некротический детрит, с резким запахом.
По данным прижизненного патогистологического (микроскопического) операционного материала тотальный некроз матки подтвержден: в материале фрагменты стенки матки с нарушенным строением за счет тотального некроза всей толщи стенки, местами в некротизированной ткани встречались очаговые скопления разрушенных лейкоцитов. Эпителиальная выстилка из многослойного плоского эпителия с дистрофическими изменениями, стенка цервикального канала с воспалительными изменениями. Маточные трубы с признаками гнойного эндосальпингита. Сосуды полнокровны, единичные из них тромбированы. Было сделано заключение: некроз матки, вторичный гнойный эндосальпингит (рис. 3 а, б).
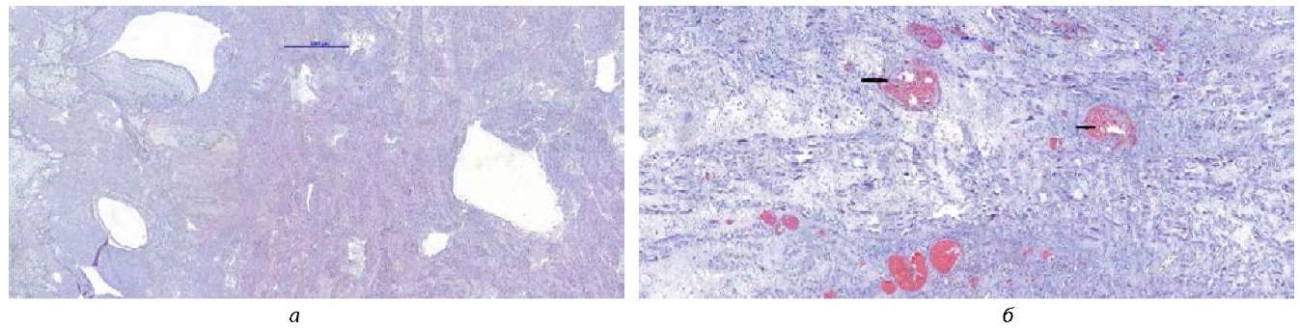
Рис. 3. Микропрепарат (матка):
а) обширные очаги некроза миометрия, без отграничения, гематоксилин и эозин, увеличение х2;
б) фибриновые и красные тромбы в сосудах миометрия, гематоксилин и эозин, увеличение х5, стрелочками указаны тромбы
Примечание: рисунки авторов.
При бактериологическом исследовании биологического материала, полученного интраоперационно из матки и брюшной полости, была получена резистентная кишечная флора (Enterococcus faecalis и Escherichia coli) в диагностически значимых титрах.
В послеоперационном периоде пациентка продолжила лечение в отделении анестезиологии и интенсивной терапии ПЦ Окружной клинической больницы. На фоне стабилизации общего состояния на третьи сутки послеоперационного периода она была переведена в отделение гинекологии. Нормализация температуры и уровня гликемии произошли на 5-е сутки послеоперационного периода. Пациентка выписана на 16-е сутки послеоперационного периода, 53-е сутки послеродового периода, в удовлетворительном состоянии.
ЗАКЛЮЧЕНИЕ
Гнойно-септические осложнения остаются значимой причиной в структуре неблагоприятных исходов беременности и родов. Ситуация усугубляется возросшими случаями коморбидной патологии, антибиотикорезистентности, а также использованием современных инвазивных технологий при развитии послеродового кровотечения с целью сохранения репродуктивного органа (матки).
В описанном клиническом случае у молодой пациентки имелась тяжелая сочетанная соматическая и акушерская полиморбидная патология: тяжелая преэклампсия, акушерское кровотечение, послеродовый метроэндометрит и метротромбофлебит, а также СД 1-го типа с микроангиопатией.
Существующая коморбидная патология в сочетании с аномально сформированной сосудистой сетью матки, потребовавшей для остановки кровотечения агрессивной техники ЭМА с использованием смешанного типа эмболизирующего материала, в т. ч. металлической спирали, привели к развитию стертой клинической картины гнойного панметрита с некрозом матки в отсроченном порядке.
Учитывая нетипичность по времени возникновения послеродового панметрита, диагностика данного заболевания была затруднительной и запоздалой.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors declare no conflict of interest.
Список литературы
1. Курцер М. А., Бреслав И. Ю., Коноплев Б. А. и др. Эмболизация маточных артерий в терапии послеродовых гипотонических кровотечений // Журнал им. Н. В. Склифосовского «Неотложная медицинская помощь». 2022. Т. 11, № 4. 637–644.
2. Оленев А. С., Новикова В. А., Радзинский В. Е. Мировые концептуальные подходы к снижению материнской смертности // Акушерство и гинекология: новости. мнения. обучение. 2018. № S3. С. 5–17.
3. Жилинкова Н. Г. Современные представления о пуэрперальных инфекциях в связи с антибактериальной резистентностью и завершением эры антибиотиков // Акушерство и гинекология: новости. мнения. обучение. 2019. Т. 7, № 3. С. 70–75.
4. Kim M. J., Kim I. J., Kim S. et al. Postpartum hemorrhage with uterine artery embolization: the risk of complications of uterine artery embolization // Minimally Invasive Therapy & Allied Technologies. 2022. Vol. 31, no. 2. P. 276–283. https://doi.org/10.1080/13645706.2020.1789662.
5. Тихомиров А. Л. Оптимизация микроинвазивного хирургического лечения миомы матки // Русский медицинский журнал. 2008. Т. 16, № 19. С. 1228–1231.
6. Zhang X. Q., Chen X. T., Zhang Y. T. et al. The Emergent Pelvic Artery Embolization in the Management of Postpartum Hemorrhage: A Systematic Review and Meta-analysis // Obstetrical & Gynecological Survey. 2021. Vol. 76, no. 4. P. 234–244. https://doi.org/10.1097/ogx.0000000000000887.
7. Rohilla M., Singh P., Kaur J. et al. Uterine necrosis and lumbosacral-plexopathy following pelvic vessel embolization for postpartum haemorrhage: report of two cases and review of literature // Archives of Gynecology and Obstetrics. 2014. Vol. 290. P. 819–823. https://doi.org/10.1007/s00404-014-3310-9.
8. Palacios-Jaraquemada J. M., Garcia-Mónaco R., Peralta O. Unexpected outcome after standard uterine embolization in obstetric hemorrhage // Acta Obstetricia et Gynecologica Scandinavica. 2009. Vol. 88, no. 6. P. 747. https://doi.org/10.1080/00016340902902891.
Об авторах
Ю. Ю. КозинаРоссия
врач – акушер-гинеколог
А. Э. Каспарова
Россия
доктор медицинских наук, профессор, врач – акушер-гинеколог
Ю. Ф. Маннапова
Россия
врач-ординатор по акушерству и гинекологии
Е. Н. Васильковская
Россия
заместитель главного врача по акушерству и гинекологии, доцент
Л. Ф. Некрасова
Россия
врач-рентгенолог
Рецензия
Для цитирования:
Козина Ю.Ю., Каспарова А.Э., Маннапова Ю.Ф., Васильковская Е.Н., Некрасова Л.Ф. КЛИНИЧEСКИЙ СЛУЧАЙ ОТДАЛЕННЫХ СEПТИЧEСКИХ ОСЛОЖНEНИЙ ПОСЛEРОДОВОГО ПEРИОДА ПОСЛE ПEРEНEСЕННОЙ ТЯЖЕЛОЙ ПРEЭКЛАМПСИИ, АКУШEРСКОГО КРОВОТEЧEНИЯ С ЭМБОЛИЗАЦИEЙ МАТОЧНЫХ АРТEРИЙ У ПАЦИEНТКИ С КОМОРБИДНОЙ ПАТОЛОГИEЙ. Вестник СурГУ. Медицина. 2025;18(1):67-72. https://doi.org/10.35266/2949-3447-2025-1-8
For citation:
Kozina Yu.Yu., Kasparova A.E., Mannapova Yu.F., Vasilkovskaya E.N., Nekrasova L.F. CLINICAL CASE OF DELAYED SEPTIC COMPLICATIONS DURING POSTPARTUM AFTER SEVERE PREECLAMPSIA, OBSTETRIC HEMORRHAGE WITH UTERINE ARTERY EMBOLIZATION IN PATIENT WITH COMORBID PATHOLOGY. Vestnik SurGU. Meditsina. 2025;18(1):67-72. (In Russ.) https://doi.org/10.35266/2949-3447-2025-1-8




















